Ein Thiol ist - einfach gesagt - eine Verbindung R-OH, bei der das Sauerstoff-Atom durch ein Schwefel-Atom ersetzt wurde. Eine andere Sichtweise ist die, dass Thiole Abkömmlinge des Schwefelwasserstoffs H2S sind, bei dem ein H-Atom durch eine organische Gruppe ersetzt wurde [1].
Thiole haben also die allgemeine Grundformel R-SH, wobei R ein Alkyl- oder Aryl-Rest ist.
Wenn R ein einfacher Alkylrest ist, bezeichnet man R-SH als Thioalkohol. Handelt es sich bei R dagegen um einen Arylrest (aromatischer Rest), spricht man von Thiophenolen. Beide zusammen, Thioalkohole und Thiophenole, bilden zusammen die Stoffgruppe der Thiole [2].
Die SH-Gruppe selbst wird als Thiol-Gruppe bezeichnet. Der Begriff "Thio" kommt übrigens aus dem Griechischen "theion" und heißt nichts anderes als "Schwefel", die Silbe "ol" soll an die Verwandtschaft zu Alkoholen erinnern.
Wegen ihrer Fähigkeit, Quecksilber(II)-Ionen Hg2+ zu binden, wurden Thiole oft auch als Mercaptane bezeichnet[2,4]. Kommt die SH-Gruppe in einer Verbindung mit einer funktionellen Gruppe vor, die eine höhere Priorität hat, beispielsweise zusammen mit einer OH-Gruppe, wird die SH-Gruppe als Mercapto-Gruppe bezeichnet.
Eigenschaften
Geruch
Viele Thiole riechen sehr streng, teils nach Knoblauch oder verfaulten Eiern, was ihre Verwandtschaft mit dem Schwefelwasserstoff unterstreicht. Oft werden solche streng riechenden, aber nicht besonders giftigen Thiole Gasen wie Erdgas oder Campinggas beigemischt, die an sich geruchlos sind. Der typische Gasgeruch ist dann auf die Thiole zurückzuführen.
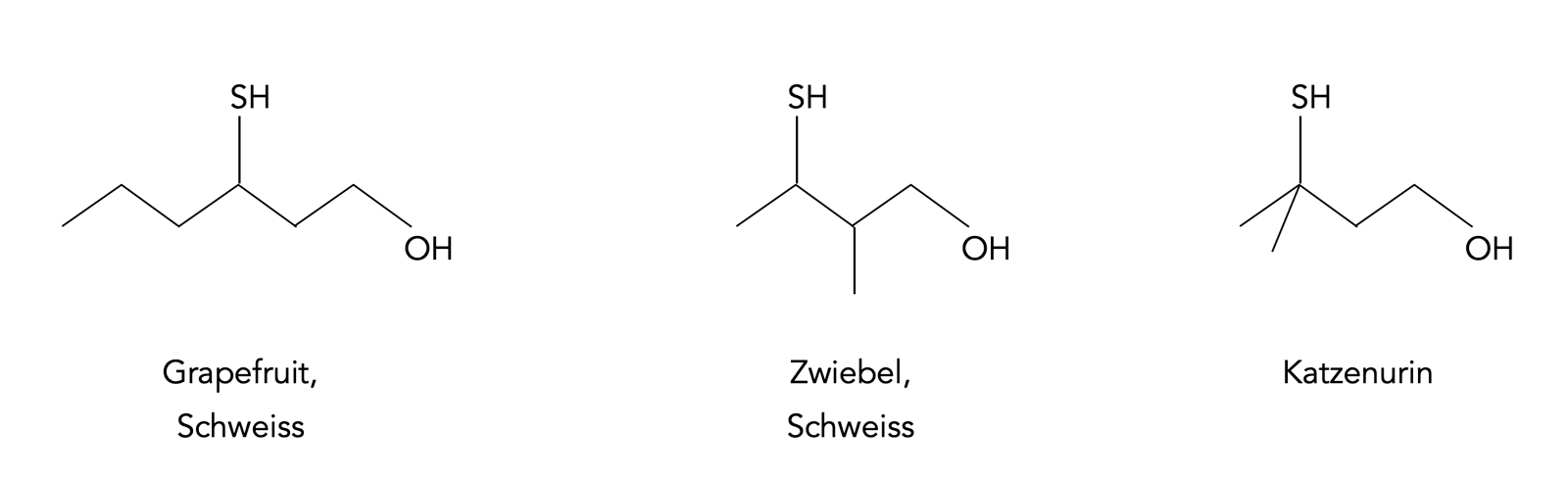
Drei Sulfanylalkohole aus der Natur [8]
Autor: Ulrich Helmich, Lizenz: ---
Die obige Abbildung zeigt drei Sulfanylalkohole, das sind Verbindungen mit einer OH- und einer SH-Gruppe. Da die OH-Gruppe eine höhere Priorität hat als die SH-Gruppe, werden diese Verbindungen als "Alkohole" bezeichnet, und die Existenz der SH-Gruppe wird durch das Präfix "Sulfanyl" gekennzeichnet. In der Natur kommen viele dieser Sulfanylalkohole vor, sie werden in den Lebewesen meistens aus der Aminosäure Cystein hergestellt, die eine SH-Gruppe in ihrem Rest besitzt [9].
Aber nicht alle Thiole bzw. Sulfanylalkohole riechen unangenehm. So riecht beispielsweise 1-p-Menthen-8-thiol nach Grapefruit. Diese Substanz ist so geruchsintensiv, dass 1 kg das gesamte Wasser des Bodensees aromatisieren könnte [7].
Siedepunkte
Die Siedepunkte der Thioalkohole sind durchweg niedriger als die der entsprechenden Alkohole. Während Methanol CH3-OH bei 65 ºC siedet, beträgt der Siedepunkt von Methanthiol CH3-SH nur 6,2 ºC. Ursache hierfür ist die Tatsache, dass die Moleküle der Thioalkohole so gut wie keine Wasserstoffbrücken-Bindungen untereinander eingehen können. Das liegt vor allem an der Größe des S-Atoms (eine Schale mehr als das O-Atom) und der daraus folgenden geringeren Elektronegativität. Die S-H-Bindung ist daher nur schwach polar und ist nicht in der Lage, H-Brücken auszubilden. Die Siedepunkte der Thioalkohole ähneln mehr denen der Halogenalkane (CH3-Br siedet bei 3,6 ºC) [5].
Herstellung
1. Nucleophile Substitution an Halogenalkanen und ähnlichen Verbindungen
Thioalkohole können leicht durch nucleophile Substitution aus Verbindungen des Typs R-X mit X=Cl, Br, I, SO3- u.a. hergestellt werden.
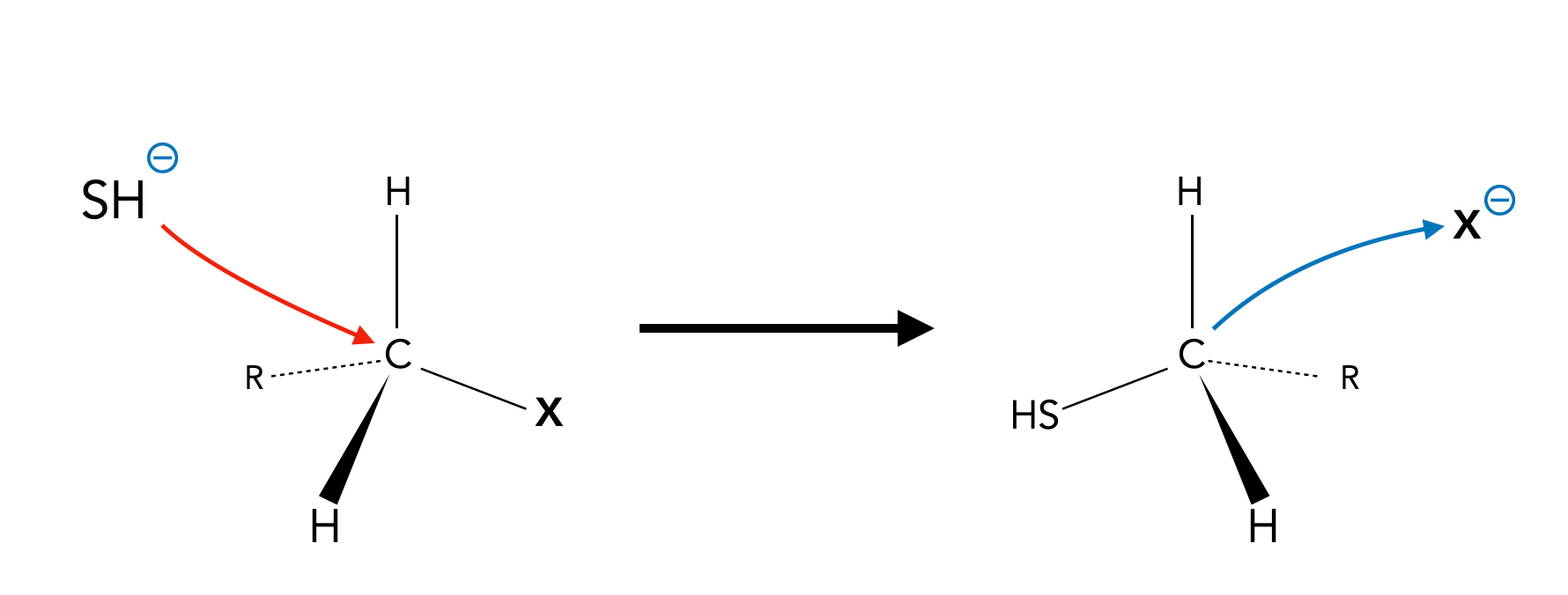
Herstellung eines Thiols durch Nucleophile Substitution
Autor: Ulrich Helmich 2023, Lizenz: Public domain.
Das SH--Ion kann beispielsweise durch Zugabe von Natriumhydrogensulfid NaSH erhalten werden [4], das man im Labor aus wasserfreiem Natriumethanolat und Schwefelwasserstoff gewinnt [3].
Die Umsetzung gelingt, weil das SH--Ion nucleophiler (und weniger basisch) ist als das OH-- oder das Cl-- bzw. Br--Ion. Diese Ionen können daher leicht als Nucleofuge aus dem Alkohol oder Halogenalkan verdrängt werden [5].
Allerdings können bei dieser Substitution leicht Thioether als Nebenprodukte gebildet werden [2,4]. Das versucht man, durch einen Überschuss an SH--Ionen zu kompensieren.
2. Alkylierung von Thioharnstoff
Eine effizientere Methode zur Herstellung von Thioalkoholen ist die Alkylierung von Thioharnstoff:
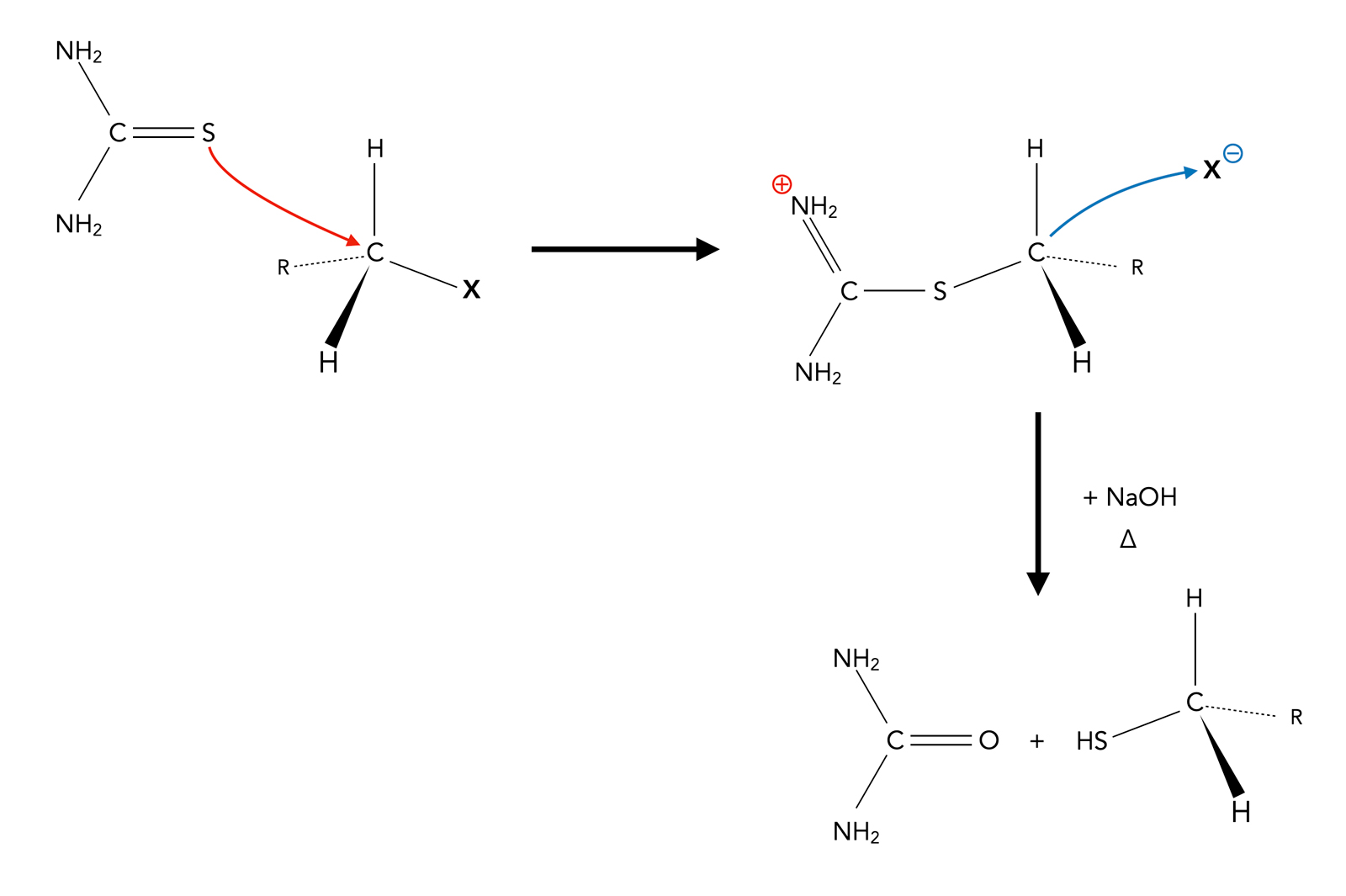
Alkylierung von Thioharnstoff
Autor: Ulrich Helmich 2023, Lizenz: Public domain.
Dieses Verfahren heißt zwar "Alkylierung von Thioharnstoff", aber aus einer anderen Perspektive betrachtet handelt es sich wieder um eine nucleophile Substitution an einem Halogenalkan (oder einer verwandten Verbindung R-X) durch Thioharnstoff als Nucleophil. Nach dieser Sichtweise wird also nicht der Thioharnstoff alkyliert, sondern die Alkylverbindung wird "verthioharnstofft". Zunächst bildet sich als Zwischenprodukt ein Thiuronium-Kation mit X- als Gegen-Anion [1,2], und durch Zugabe von Natronlauge findet dann eine Zersetzung des Zwischenproduktes in den Thioalkohol und Harnstoff statt.
3. Addition an Alkene und verwandte Verbindungen
Auch durch radikalische Addition von H2S an ein Alken kann man Thioalkohole synthetisieren [5,6].
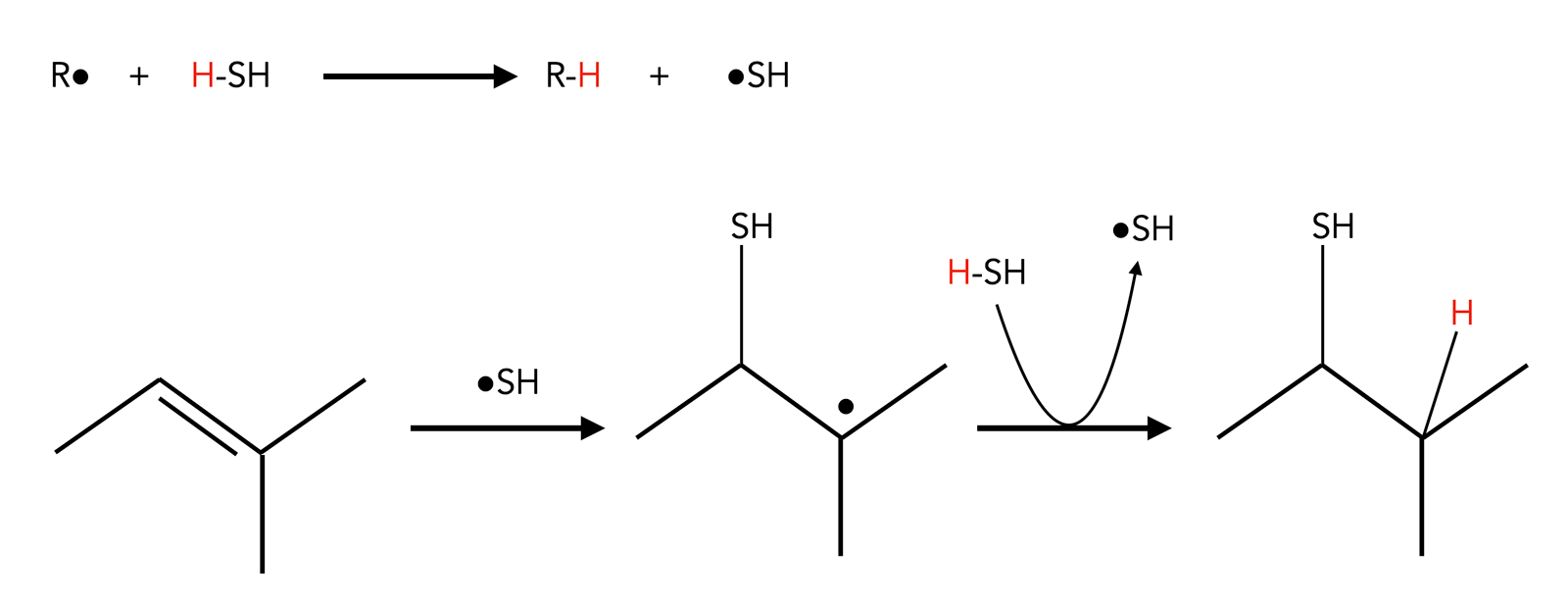
Radikalische Addition von CCl4
Autor: Ulrich Helmich 2023, Lizenz: Public domain.
Ein Radikalstarter abstrahiert ein H-Atom aus einem H2S-Molekül, und das •SH-Radikal greift dann die C=C-Doppelbindung an. Es bildet sich ein stabiles Alkyl-Radikal, das dann wieder ein H-Atom aus einem neuen H2S-Molekül abstrahiert. Es entsteht ein Thiol als Anti-Markownikow-Produkt.
In Anwesenheit von Säuren kann sich aber auch ein Proton an die Doppelbindung setzen, so dass sich ein Carbenium-Ion bildet, an das sich dann ein SH--Ion anlagern kann. Dann verläuft die Reaktion als elektrophile Addition [4].
Reaktionen
Im Prinzip verhalten sich Thiole (Thioalkohole und Thiophenole) chemisch wie ihre Sauerstoff-Verwandten, die Alkohole und Phenole. Thiole können Salze bilden (Thiolate), und sie können als Anionen als Nucleophile reagieren.
Allerdings hat das Schwefel-Atom eines Thiols eine zusätzliche Elektronenschale mit s, p und d-Orbitalen, und das erweitert die Reaktionsmöglichkeiten erheblich. Mit starken Oxidationsmitteln (H2O2, KMnO4) kann man Thiole in die entsprechenden Sulfonsäuren umwandeln [5]:
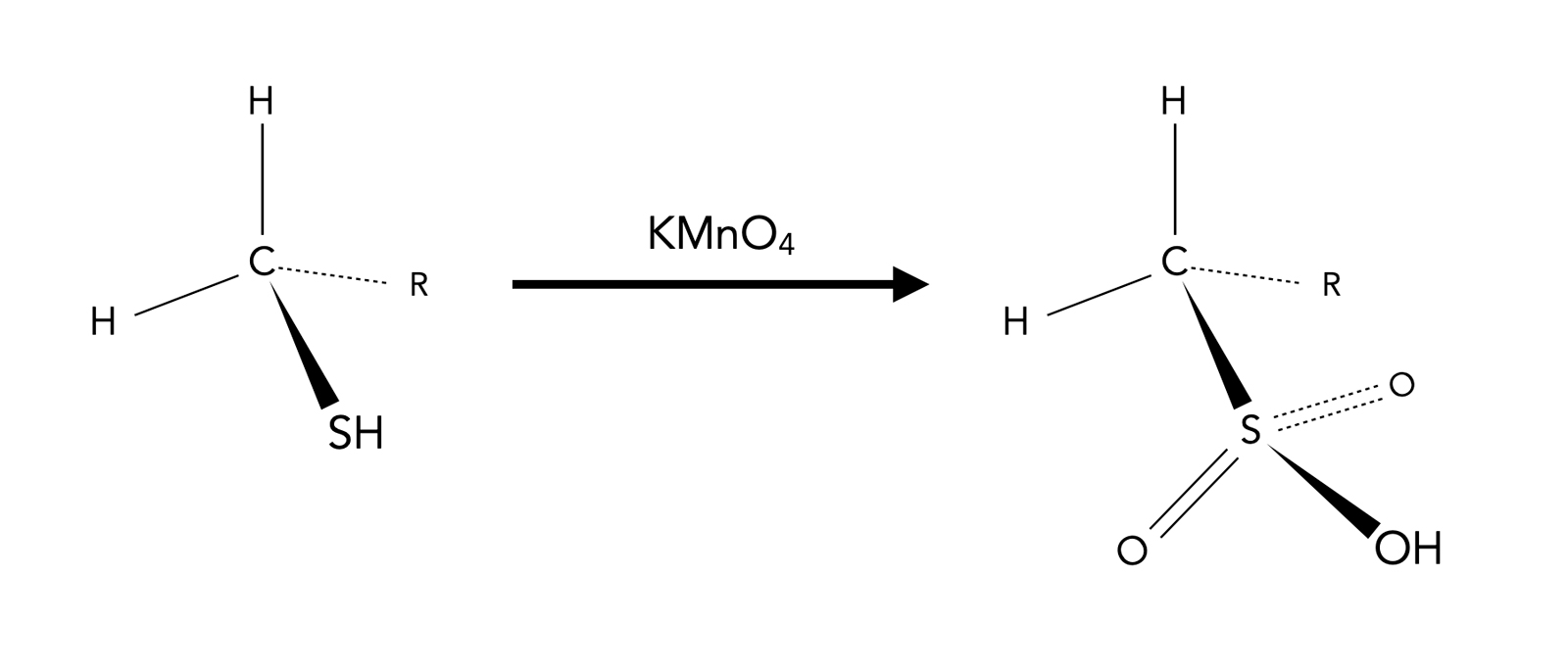
Bildung einer Sulfonsäure aus einem Thiol
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Die Seite wird noch fortgesetzt...
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Thiole"
- Wikipedia, Artikel "Natriumhydrogensulfid"
- engl. Wikipedia, Artikel "Thiol"
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schieberle, Hoffmann: "Die molekulare Welt des Lebensmittelgenusses", Chemie in unserer Zeit 2003, S. 388ff.
- Natsch: "Der menschlichen Duftchemie auf der Spur", Chemie in unserer Zeit 2012, S. 110ff
- "Dem Schweißgeruch auf der Spur" auf Chemie.de, Artikel vom 12.10.2004.