Definition
Unter dem Begriff Kondensation versteht man eine chemische Reaktion, bei der sich zwei größere Moleküle unter Abgabe eines kleineren Moleküls wie zum Beispiel Wasser, Ammoniak oder Chlorwasserstoff vereinigen.
Der Begriff "Kondensation" leitet sich vom lateinischen "condensare" her, was so viel wie "verdichten" bedeutet.
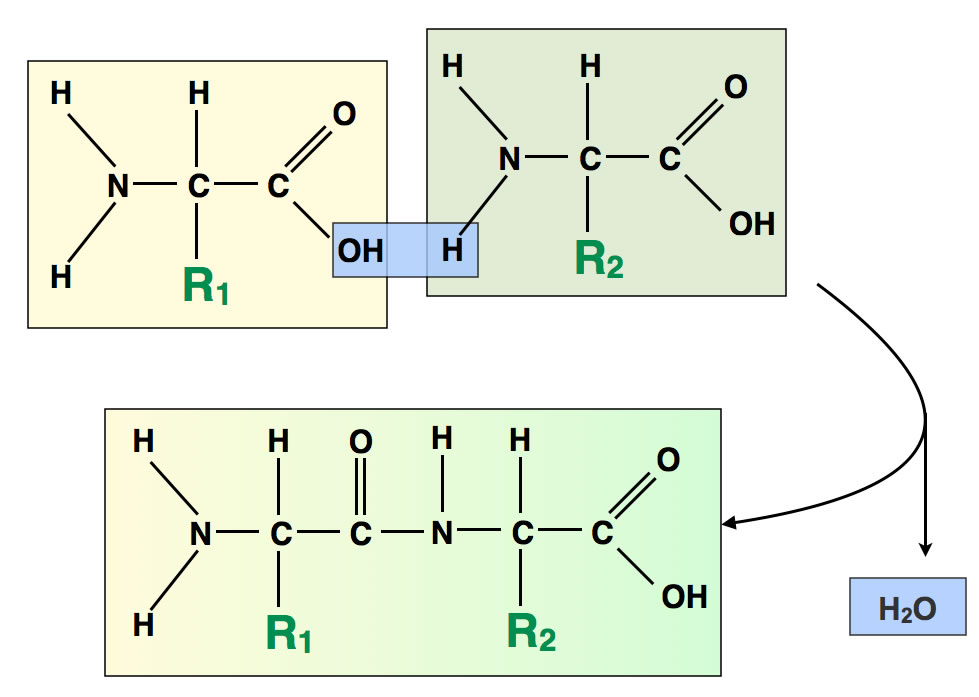
Kondensation zweier Aminosäuren zu einem Dipeptid
Autor: Ulrich Helmich 2015, Lizenz: Public domain.
Hier sieht man ein typisches Beispiel für eine Kondensationsreaktion: Die Vereinigung von zwei Aminosäuren zu einem Dipeptid unter Austritt von Wasser.
Kondensieren können zwei Moleküle, wenn sie über bestimmte funktionelle Gruppen verfügen.
Die OH-Gruppe ist dabei wohl als erste zu nennen. Zwei OH-Gruppen können unter Wasser-Abgabe leicht kondensieren, übrig bleibt dann eine Sauerstoff-Brücke, welche die beiden Moleküle verbindet: R1-O-R2. Diesen Kondensationstyp findet man beispielsweise bei der Bildung von Disacchariden und Polysacchariden aus Monosacchariden, bei der Bildung von Peptiden und Proteinen aus Aminosäuren, bei der Bildung von Estern und Polyestern aus Sauerstoffsäuren und Alkoholen und so weiter.
Auch die Amino-Gruppe NH2 ist für eine Kondensationsreaktion geeignet, wie die Bildung von Peptiden und Proteinen aus Aminosäuren zeigt. Allerdings muss die Amino-Gruppe dazu mit einer Hydroxy-Gruppe reagieren, damit sich ein H2O-Molekül bilden kann. Zwei NH2-Gruppen können daher nicht kondensieren - jedenfalls nicht unter Bildung von H2O.
Ein "exotisches" Beispiel für Kondensationen sind die Polycarbonate, bei denen Phosgen-Moleküle mit zweiwertigen Alkoholen reagieren. Phosgen Cl2C=O ist ein Derivat der Kohlensäure, beide H-Atome sind hier durch Cl-Atome ersetzt. Die Cl-Atome können leicht abgegeben werden und reagieren dann mit dem H-Atom einer OH-Gruppe zu HCl.
Innere Kondensation[1]
Hier findet die Kondensation unter Ringbildung innerhalb eines Moleküls statt, dass dann natürlich über zwei entsprechende funktionelle Gruppen verfügen muss, zum Beispiel über zwei OH-Gruppen oder eine OH-Gruppe und eine COOH-Gruppe. Außerdem muss das Molekül groß genug sein, damit es bei der Ringbildung nicht zu allzu großen Ringspannungen kommt.
Selbstkondensation[1]
So bezeichnet man eine Kondensation, bei der nur eine Verbindung beteiligt ist. Würden beispielsweise zwei Lysin-Moleküle (Aminosäure) zu einem Dipeptid kondensieren, wäre das eine Selbstkondensation. Auch die Bildung eines Maltose-Moleküls aus zwei Glucose-Molekülen ist ein Beispiel für eine Selbstkondensation.
Allzu gebräuchlich ist dieser Fachbegriff "Selbstkondensation" allerdings nicht. Wenn man ihn googelt, landet man gleich auf dieser Seite hier.
Heterokondensation[1]
Das ist der wohl am weitesten verbreitete Kondensationstyp. Bei der Heterokondensation reagieren zwei verschiedene Moleküle miteinander.
Auch dieser Fachbegriff ist nicht sehr gebräuchlich, er wird hier nur der Vollständigkeit wegen genannt.
Polykondensation
Wenn nicht zwei Moleküle kondensieren, sondern ganz viele, spricht man von einer Polykondensation. Durch Polykondensation werden viele bekannte Kunststoffe hergestellt wie beispielsweise die Polyester. Aber auch in der Natur spielt die Polykondensation eine wichtige Rolle. Alle Polysaccharide, Proteine und Nucleinsäuren sind das Produkt einer Polykondensation.
Hydrolyse
Unter einer Hydrolyse versteht man die Umkehrung einer Kondensation, bei der Wasser ausgetreten ist. Unter Mithilfe eines Wasser-Moleküls wird ein größeres organisches Molekül in zwei kleinere gespalten. Bei der Verdauung der Kohlenhydrate, Fette und Proteine im Dünndarm spielt eine solche Hydrolyse zum Beispiel eine entscheidende Rolle.
Bedeutung der Kondensation
Kondensationsreaktionen spielen in der organischen Chemie eine große Rolle. Die Wikipedia listet eine ganze Reihe von Reaktionen auf, die zu den Kondensationen gehören[2]:
- Aldolkondensation
- Acyloin-Kondensation
- Claisen-Kondensation
- Dieckmann-Kondensation
- Etherbildung
- Nukleotidbildung
- Peptid- und Proteinbildung
- Polykondensation zur Kunststoffherstellung
- Ugi-Reaktion
- Veresterung
- Säurekondensation
Mit Hilfe von Kondensationsreaktionen werden viele wichtige Industrieprodukte hergestellt, beispielsweise Polyester.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Kondensationsreaktion", abgerufen am 2. Juli 2019