Kohlenstoff, ein vielseitiges Element
Das Element Kohlenstoff, chemisches Symbol C von lat. carbo = Holzkohle, kommt nicht nur in allen organischen Verbindungen vor, sondern auch in vielen anorganischen Stoffen.
Beispiele für organische Verbindungen:
Essigsäure, Hexan, Ethanol, Vitamin C, Traubenzucker, ...
Beispiele für anorganische Verbindungen, die Kohlenstoff enthalten:
Kohlensäure H2CO3, Kohlenstoffdioxid CO2, Kohlenstoffmonoxid CO, Calciumcarbonat CaCO3 und andere Salze der Kohlensäure, Calciumcarbid CaC2 und andere Carbide, Kohlenstoffdisulfid CS2, Blausäure HCN und Cyanide wie KCN.
Elektronenkonfiguration
Nach dem Schalenmodell:
Kohlenstoff-Atome haben die Elektronenkonfiguration K2L4. Auf der K-Schale befinden sich also zwei Elektronen, auf der L-Schale deren vier.
Nach dem Kugelwolkenmodell:
Das C-Atom hat vier tetraedrisch angeordnete Kugelwolken. Jede dieser Kugelwolken ist mit einem Elektron besetzt. Daher kann Kohlenstoff vier kovalente Bindungen mit anderen Atomen bilden.
Nach dem Orbitalmodell:
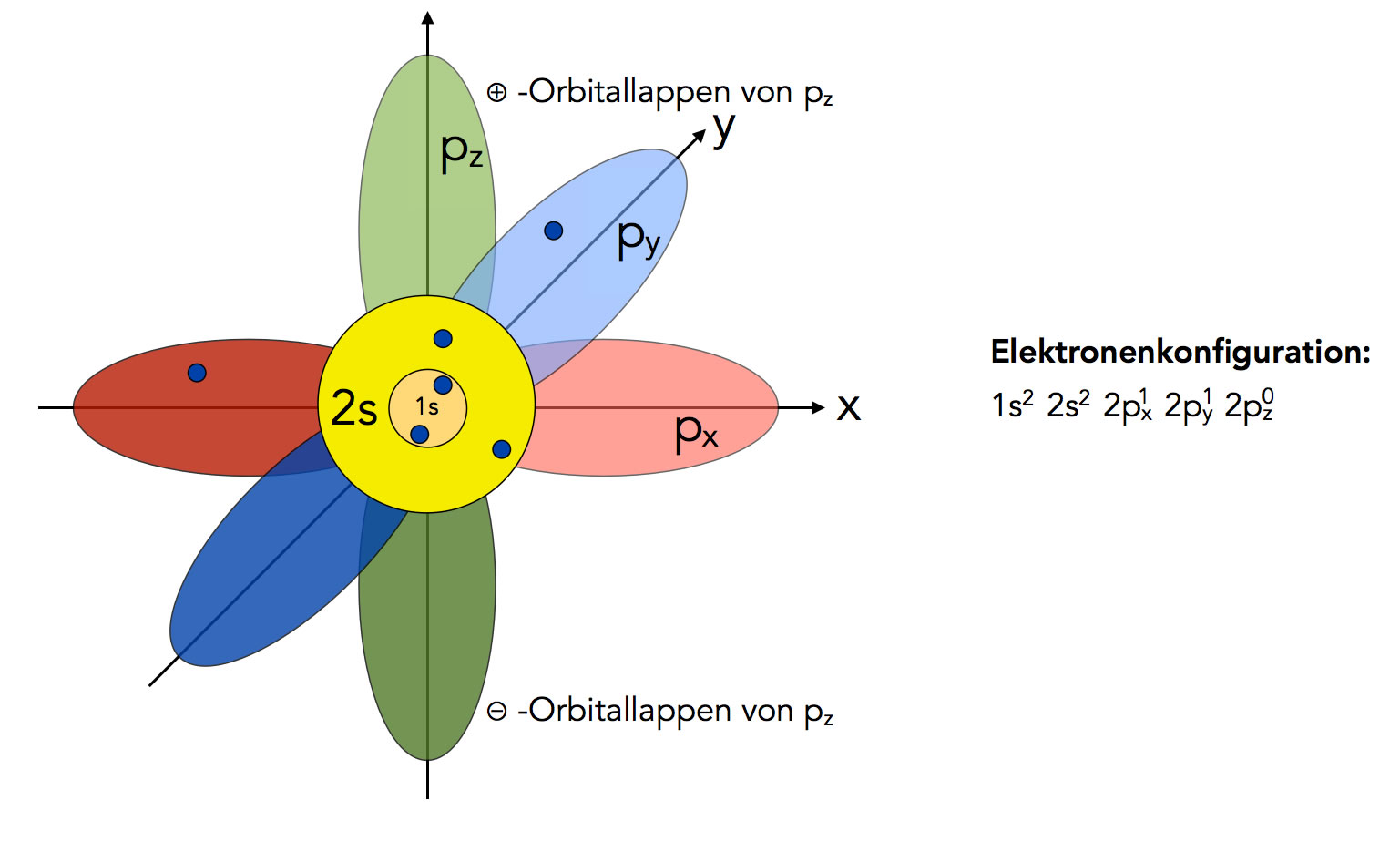
Elektronenkonfiguration des nicht-hybridisierten C-Atoms
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die Elektronenkonfiguration von Kohlenstoff ist 1s2, 2s2, 2px1, 2py1, 2pz0.
Auf der inneren Schale ist also das 1s-Orbital doppelt besetzt, auf der äußeren Schale ist das 2s-Orbital mit zwei Elektronen besetzt, und zwei 2p-Orbitale enthalten je ein Elektron. Das dritte 2p-Orbital ist leer. Demnach könnte Kohlenstoff mit seinen einfach besetzten px und py-Orbitalen zwei kovalente Bindungen mit anderen Atomen bilden und wäre wegen des leeren 2pz-Orbitals gleichzeitig eine Lewis-Säure.
Beide Annahmen widersprechen jedoch den Eigenschaften des Kohlenstoffs. Kohlenstoff ist in der Regel vierbinding, die C-H-Bindungen des Methans weisen in die Ecken eines Tetraeders (Bindungswinkel 109 Grad), und eine Lewis-Säure ist das C-Atom mit Sicherheit nicht.
Um diesen Widerspruch zu klären, hat man das Konzept der Hybridisierung eingeführt, das auf den Seiten zum Orbitalmodell auf dieser Homepage näher erklärt wird. Das sp3-hybridisierte C-Atom entspricht in seinem Aufbau in etwa dem Kugelwolkenmodell des C-Atoms. Tatsächlich ist das Kugelwolkenmodell eine didaktische Vereinfachung des Orbitalmodells.
Verhalten des C-Atoms
C-Atome gehen kovalente Bindungen ein
Metalle mit einem, zwei oder drei Außenelektronen geben diese leicht ab, um in den stabilen Edelgaszustand zu gelangen.
Nichtmetalle mit fünf, sechs oder sieben Außenelektronen gehen den umgekehrten Weg: Sie nehmen die fehlenden Elektronen auf. In beiden Fällen bilden sich Ionen, Kationen bei der Elektronenabgabe, Anionen bei der Aufnahme von Elektronen. Elemente der beiden ersten und der beiden letzten Hauptgruppen des Periodensystems bilden daher bevorzugt Ionenbindungen (von einigen Ausnahmen mal abgesehen).
Kohlenstoff hat vier Außenelektronen, steht also quasi genau in der Mitte zwischen den Metallen (Elektronenabgabe) und den Nichtmetallen (Elektronenaufnahme).
Sowohl die Abgabe von vier Elektronen wie auch die Aufnahme von vier zusätzlichen Elektronen wäre energetisch recht ungünstig. Daher bilden Kohlenstoff-Atome keine Ionenbindungen, sondern gehen kovalente Bindungen mit anderen Atomen ein.
Bei den Carbiden, Salzen wie CaC2, könnte man nun denken, dass hier Kohlenstoff-Anionen vorliegen. Das ist aber ein Fehlschluss! Carbide sind keine Salze des Kohlenstoffs, sondern Salze des Ethins. Ethin-Anionen C22- entstehen, wenn Ethin-Moleküle zwei Protonen abgeben.
Kohlenstoff-Atome können lange Ketten und Ringe bilden
Kohlenstoff kann extrem viele verschiedene und teils recht komplexe Verbindungen bilden. Manche Kunststoffe wie Polyethylen enthalten Tausende oder Zehntausende C-Atome in jedem Molekül, und die DNA des Menschen besteht aus 46 Molekülen, von denen jedes Hunderttausende Kohlenstoff-Atome enthält.
Das liegt daran, dass Kohlenstoff-Atome eine starke Neigung haben, sich mit anderen Kohlenstoff-Atomen zu verbinden. So entstehen kurze, mittellange, lange und sehr lange Kohlenstoff-Ketten, aber auch Ringe aus drei, vier oder mehr C-Atomen.
Weitere Informationen
Viele weitere Informationen über das Elemente Kohlenstoff und seine Modifikationen Graphit, Diamant und Fullerene finden Sie auf den unter "Externe Links" aufgeführten Webseiten. Besonders gut gefallen hat mir persönlich die sehr ausführliche und reich bebilderte Darstellung auf Periodensystem-online.de.