van-der-Waals-Wechselwirkungen
Die Keesom-Wechselwirkung gehört zu den van-der-Waals-Wechselwirkungen.
Grundsätzlich kann man drei Typen der van-der-Waals-Wechselwirkungen beobachten.
- Anziehung permanenter Dipol - permanenter Dipol (Keesom-Wechselwirkung, 2-25 kJ/mol)
- Anziehung permanenter Dipol - polarisierbares Teilchen (Debye-Wechselwirkung, 2-10 kJ/mol)
- Anziehung polarisierbares Teilchen - polarisierbares Teilchen (London-Wechselwirkung, 0,1-40 kJ/mol)
Als Keesom-Kräfte werden die Anziehungskräfte zwischen permanenten Dipolen wie zum Beispiel Aceton- oder Wasser-Molekülen bezeichnet.
In älteren Büchern wird die Keesom-Kraft meistens als Dipol-Dipol-Kraft bezeichnet, auch in der Wikipedia ist das der Fall.
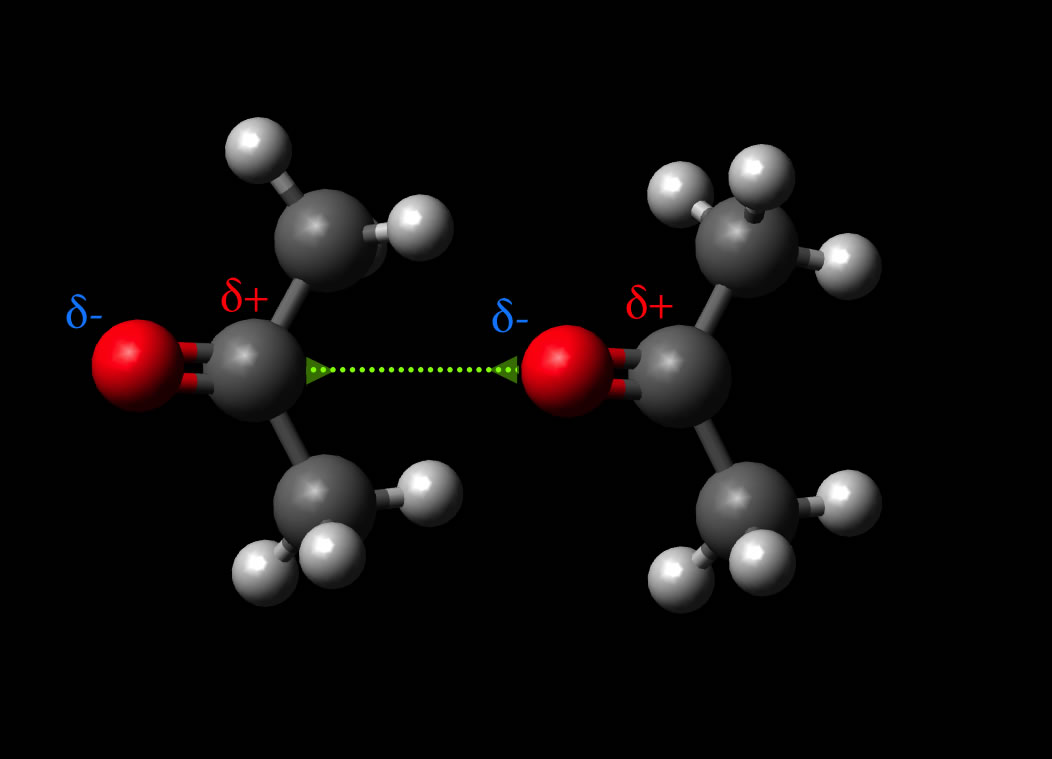
Dipol-Dipol-Wechselwirkung zwischen zwei permanenten Aceton-Dipolen
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sehen wir zwei Aceton-Moleküle, die sich so ausgerichtet haben, dass sie sich gegenseitig anziehen - über die Keesom-Kraft.
Neben der Keesom-Kraft wirken aber auch die beiden anderen Komponenten der van-der-Waals-Kraft bei dieser zwischenmolekularen Anziehungskraft mit, vor allem die London-Kraft hat einen wichtigen Einfluss.
Faktoren, von denen die Keesom-Kraft abhängt
Die Stärke der Dipol-Dipol-Wechselwirkung hängt im Wesentlichen von zwei Faktoren ab: Der Stärke der Dipole und dem Abstand zwischen den Molekülen.
Die Energie einer Keesom-Wechselwirkung lässt sich nach folgender Formel berechnen:
$E = -\frac{2 \cdot \mu_1^2 \cdot \mu_2^2}{3 \cdot k_B \cdot T \cdot r^6}$
Dabei sind $\mu_1, mu_2$ die Dipolmomente der Moleküle in Debye, $r$ der Abstand zwischen den Molekülen und $T$ die absolute Temperatur in Kelvin. $k_B$ ist die Boltzmann-Konstante (1,38 * 10-23 J/K).
Auf dieser Lexikon-Seite erfahren Sie mehr über die Dipol-Dipol-Wechselwirkung bzw. die Keesom-Kraft.
Die Keesom-Kraft gehört zu den van-der-Waals-Wechselwirkungen, auf dieser Seite erhalten Sie einen Überblick über die drei (bzw. vier) Komponenten dieser wichtigen intermolekularen Wechselwirkung.
Diese Seite wurde speziell für Schüler(innen) der Stufen 10 und 11 geschrieben. Hier wird anschaulich erklärt, was ein Dipol ist und wie die Anziehungskräfte zwischen permanenten Dipolen zustande kommen.