Als Fluoreszenz bezeichnet man eine einfache Form der Lumineszenz. Durch Absorption von Licht (UV oder sichtbar) werden Elektronen energetisch angeregt und "springen" von einem Grundzustand auf ein höheres Energieniveau, einen angeregten Zustand. Bei diesen "Zuständen" handelt es sich bei organischen Molekülen immer um bestimmte Molekülorbitale (kurz MOs). Das höchste von Elektronen besetzte MO wird als HOMO bezeichnet (highest occupied molecular orbital), das niedrigste noch nicht von Elektronen besetzte MO heißt LUMO (lowest unoccupied molecular orbital). Bei Absorption von Licht springt ein Elektron also vom HOMO auf das energetisch höher liegende LUMO oder sogar auf ein noch höheres MO.
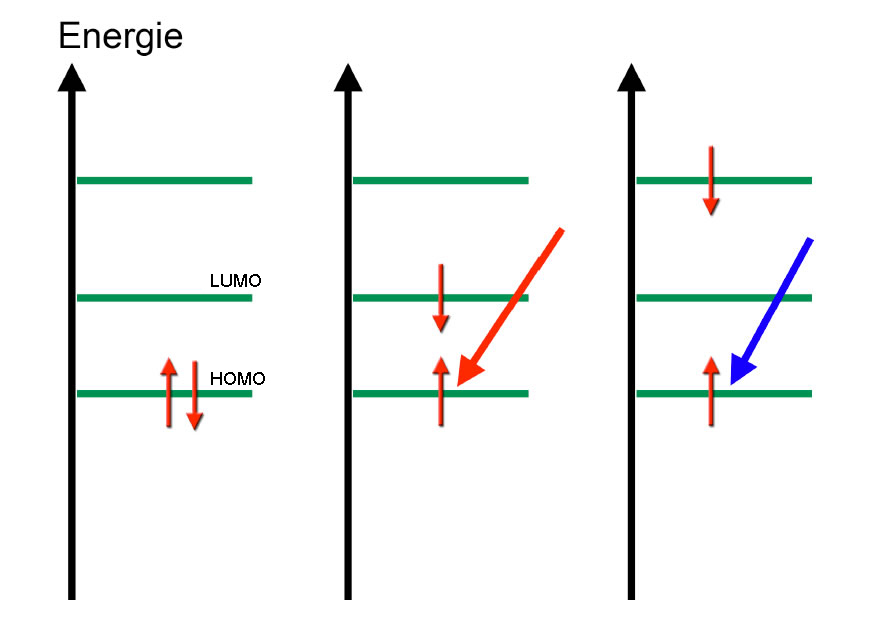
Absorption von rotem und blauem Licht
Hier ein Beispiel. Energiearmes Rotlicht befördert ein HOMO-Elektron auf das LUMO-Niveau. Energiereiches Blaulicht schafft es sogar, das Elektron auf ein darüber liegendes MO zu befördern.
Bei der Fluoreszenz "fallen" die derart angeregten Elektronen nun einfach auf das HOMO zurück. Dabei wird Energie in Form von Photonen (Licht) frei.
Allerdings gilt hier die Stokessche Regel. Die bei der Fluoreszenz emittierten (abgestrahlten) Photonen haben stets eine geringere Energie als die zuvor absorbierten Photonen. Es tritt also ein Energieverlust auf.