Unter dem Begriff Elektronendichte versteht man die Aufenthaltswahrscheinlichkeit von Elektronen in einem Molekül oder Ionenkristall.
Für den Chemieunterricht spielt die Elektronendichte vor allem im Zusammenhang mit der Polarität von kovalenten Bindungen eine wichtige Rolle. Bei einer unpolaren kovalenten Bindung ist die Elektronendichte in der gemeinsamen Bindungskugelwolke (Bindungsorbital, sigma-Orbital) überall ungefähr gleich hoch. Bei einer polaren kovalenten Bindung dagegen ist die Elektronendichte in der Nähe des elektronegativeren Atoms höher.
Bei dem induktiven Effekt spielt die Elektronendichte ebenfalls eine wichtige Rolle. In einem wissenschaftlichen Artikel von 1970 [4] findet man folgende Tabelle, die hier stark vereinfacht dargestellt wird.
| Alkan | E. am primären C-Atom | E. am sek./tert. C-Atom |
| Propan | -8,8 | 23,6 |
| 2-Methylpropan | -9,1 | 46,0 |
| 2,2-Dimethylpropan | -8,7 | 61,5 |
Hier eine graphische Darstellung:

Elektronendichten in drei Alkanen
Autor: Ulrich Helmich 08/2024, Lizenz: Public domain.
Die Elektronendichte ist an den zentralen C-Atomen deutlich höher als an den peripheren. Diese Tatsache ist dann als +I-Effekt bekannt: Alkyl-Gruppen "schieben" Elektronen in Richtung Zentralatom.
Noch extremer verteilt ist die Elektronendichte innerhalb eines Ionenkristalls. Dort wo sich die Anionen befinden, ist die Elektronendichte sehr hoch, und bei den Kationen ist sie entsprechend niedrig.
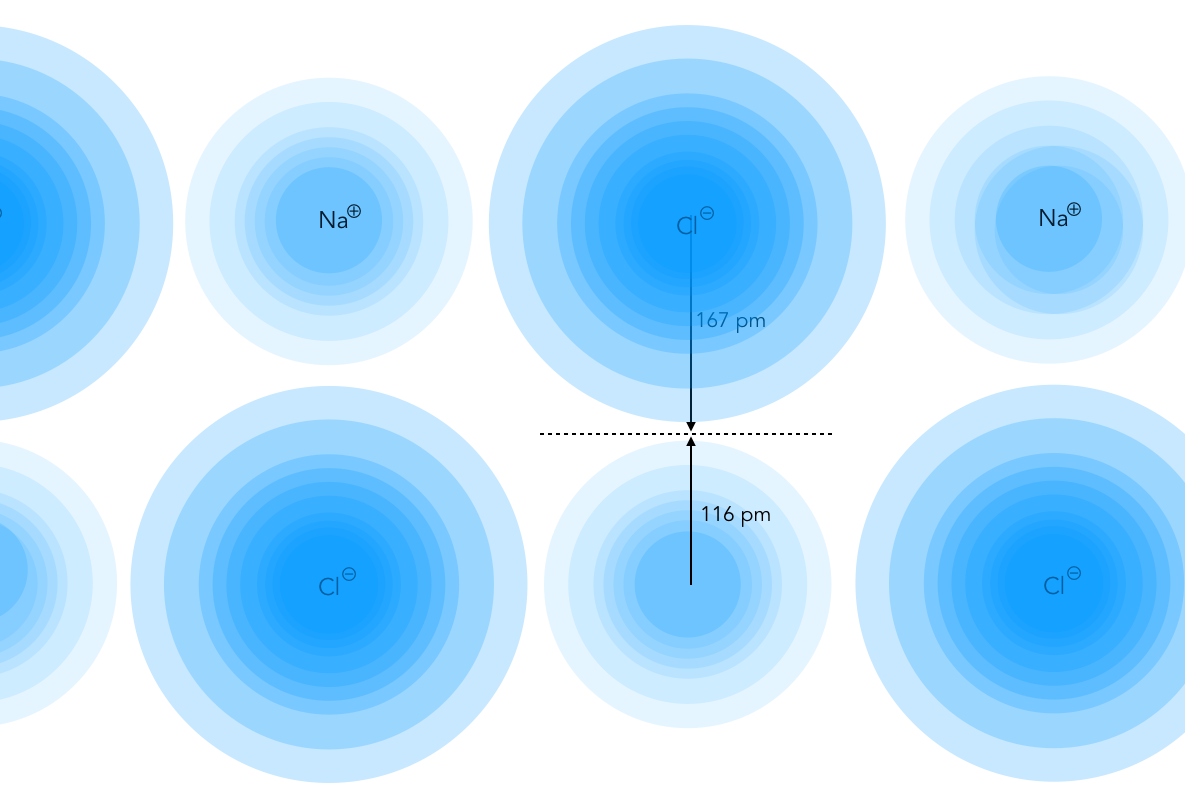
Elektronendichteverteilung in einem NaCl-Kristall
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Auch in diesem Bild ist eine hohe Elektronendichte durch die Farbe Blau darstellt. Häufig sieht man im Internet oder auch in der Fachliteratur jedoch das genaue Gegenteil: Hohe Elektronendichte = Rot, niedrige Elektronendichte = Blau.
Quellen:
- Spektrum Lexikon der Physik, 1998
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Elektronendichte"
- Artikel "Berechnung der Elektronendichte von Alkanen nach dem S-DIAG-Verfahren zur Interpretation chemischer Verschiebungen" in der Zeitschrift für Naturforschung 25 a, 1716-1720, vom 7. August 1970.