Man unterteilt Gleichgewichte grundsätzlich in zwei Klassen: statische Gleichgewichte und dynamische Gleichgewichte.
Statische Gleichgewichte heißen so, weil sich im Prinzip nichts mehr ändert, sobald sich das Gleichgewicht eingestellt hat. Wenn eine Kugel den Berg herunter rollt und in einer Mulde liegen bliebt, bleibt sie dort so lange liegen, bis jemand sie anstößt oder sie aus der Mulde herausnimmt.
Dynamische Gleichgewichte sind immer in Bewegung - daher die Bezeichnung "dynamisch". Für den außenstehenden Betrachter ist das nicht immer ersichtlich, wenn er jedoch genau hinschaut, sieht er, dass der Gleichgewichtszustand dynamisch ist.
Beispiele für dynamische Gleichgewichte
Waschbecken mit Wasser
Wenn man Wasser aus dem Wasserhahn in das Waschbecken fließen lässt und pro Zeiteinheit genau so viel Wasser abfließt, wie zufließt, dann verändert sich der Wasserstand im Becken nicht mehr. Es hat sich ein Gleichgewicht zwischen Zufluss und Abfluss eingestellt: Zufluss = Abfluss.
Diffusion durch eine Membran
Wenn sich auf der linken Seite einer durchlässigen Membran anfangs viele gelöste Teilchen befinden und auf der rechten Seite wenige, dann kommt es zu einem Konzentrationsausgleich durch Diffusion. Wenn der Konzentrationsausgleich erreicht ist, hat sich ein dynamisches Gleichgewicht eingestellt: Pro Zeiteinheit diffundieren genau so viele Teilchen von links nach rechts wie von rechts nach links: Diffusion nach links = Diffusion nach rechts.
Für den außenstehenden Betrachter bleiben die Konzentrationen auf der linken und der rechten Seite jedoch gleich, er könnte dieses dynamische Gleichgewicht für ein statisches halten.
Räuber-Beute-Gleichgewicht
Wenn in einem Ökosystem die Zahl der Beutetiere zunimmt, vermehren sich auch die Raubtiere. Dies führt dazu, dass mehr Beute gefressen wird, die Zahl der Beutetiere sinkt. Das hat aber zur Folge, dass die Raubtiere weniger zu fressen haben, ihre Zahl nimmt ebenfalls ab. Dadurch werden weniger Beutetiere gerissen, die Zahl der Beutetiere steigt wieder. Und so geht das immer weiter; im Idealfall verändert sich im zeitlichen Mittel die Zahl der Beutetiere nicht mehr, und die Zahl der Raubtiere bleibt im Zeitmittel ebenfalls konstant. Auch hier hat sich ein - allerdings etwas komplexeres - dynamisches Gleichgewicht eingestellt.
Dynamische Gleichgewichte in der Chemie
Nicht nur in der Physik (Waschbecken-Beispiel) oder in der Biologie (Diffusion- und Räuber-Beute-Beispiel) spielen dynamische Gleichgewichte eine Rolle, sondern auch bei chemischen Reaktionen.
Wenn man Kohlendioxid in Wasser löst, reagiert nur ein sehr kleiner Anteil des gelösten Kohlendioxids CO2(g) mit dem Wasser H2O(l) gemäß
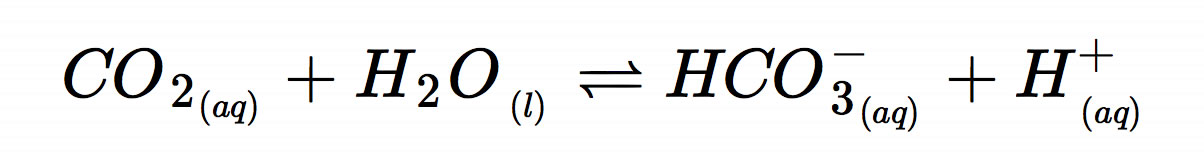
zu hydratisierten Hydrogencarbonat-Ionen HCO3-(aq)und Protonen H+(aq). Man sagt, das Gleichgewicht dieser Reaktion liegt weit auf der linken Seite. Es handelt sich aber um ein dynamisches Gleichgewicht, denn pro Zeiteinheit reagieren genau so viele Edukt-Teilchen miteinander zu Produkt-Teilchen, wie Produkt-Teilchen zurück reagieren zu Edukt-Teilchen. Oder einfacher ausgedrückt: vHin = vRück, wobei vHin die Geschwindigkeit der Hinreaktion ist und vRück die Geschwindigkeit der Rückreaktion.
Ein anderes Beispiel ist die Bildung von Estern aus Carbonsäuren und Alkoholen. Im Chemieunterricht wird dieser Reaktionstyp gerne am Beispiel Essigsäure-ethylester behandelt. Auch hier bildet sich ein dynamisches Gleichgewicht aus:
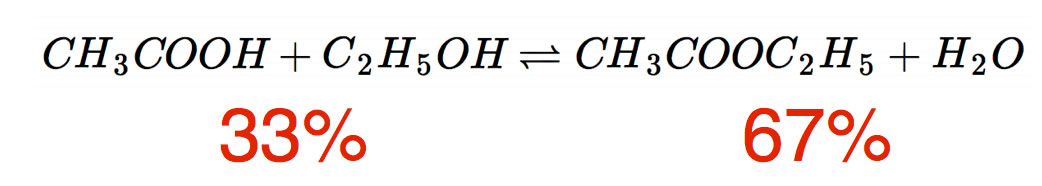
Bei Zimmertemperatur reagiert immer genau 67% der Essigsäure mit dem Alkohol zu dem Ester, 33% der Essigsäure werden bei der Reaktion nicht verbraucht.
Beginnt man die gleiche Reaktion "auf der anderen Seite", nimmt man also den Ester und lässt ihn bei Zimmertemperatur mit Wasser reagieren, so stellt sich das selbe Gleichgewicht ein; nach einiger Zeit liegen in dem Stoffgemisch wieder 67% Ester und 33% Säure und Alkohol vor.