Bezüge zum Kernlehrplan und den Vorgaben 2023
Tatsächliche Schwerpunkte dieser Aufgabe
- Redoxreaktionen von Metallen (Bsp. Eisen in Silbernitrat-Lösung)
- Bestimmung der Masse des abgeschiedenen Metalls (Faraday-Gesetz)
- Galvanisches Versilbern
- Redoxpotenziale, Standardpotenziale, Reaktionen an Elektroden
- Korrosion von Silber, Bildung von Ag2O und Ag2S
1. Materialien Grundkurs
Zunächst wird einleitend auf das Element Silber eingegangen, zum Beispiel das es bakterientötend wirkt, so dass Silberbesteck nicht nur schön, sondern auch hygienisch ist. Dann wird näher auf das Thema Silberbesteck eingegangen. Dieses besteht nicht aus reinem Silber, das wäre nämlich zu weich, sondern aus Stahl, der galvanisch mit einer dünnen Silberschicht überzogen wird.
Experimente zum Versilbern einer Gabel
Versuch a) In einem Laborexperiment wurde nun eine Eisengabel in eine Silbernitrat-Lösung gestellt. Man sah, dass sich in kurzer Zeit kleine schwarze Verästelungen an der Gabel bildeten.
Versuch b) In einem Becherglas befand sich eine alkalische AgNO3-Lösung der Konzentration 1 mol/l. Eine Eisengabel und ein Silberblech wurden nun als Elektroden verwendet und an eine Gleichspannungsquelle angeschlossen. Dann wurde für 10 Minuten eine Stromstärke von 5 Ampere angelegt.
Versuch c) Hier wurde die Eisengabel durch eine Graphitelektrode ersetzt, die sich bei dem Versuch ebenfalls mit einer Silberschicht überzog. Allerdings konnte man hier an der Graphitelektrode eine Gasentwicklung beobachten, was bei der Eisengabel nicht der Fall war.
Anlaufen von Silber
Hier wird aus einem nicht näher genannten Buch zu Korrosion und Korrosionsschutz zitiert:
"In trockenen und feuchten Atmosphären ist Silber immun gegen korrosiven Angriff. Eine Oxidation zu Ag2O unterhalb 180 °C ist zwar nachzuweisen, eine sichtbare Oxidschicht tritt nicht auf."
"Die Ursache für dieses Anlaufen sind dünne Schichten aus dem schwarzen Ag2S, die sich an der Oberfläche bilden, selbst wenn nur Spuren von H2S in der Atmosphäre zugegen sind. Über den Reaktionsmechanismus ist man sich nicht im Klaren, und auch die stöchiometrischen Verhältnisse sind nicht geklärt. Im Einzelnen ist die Frage offen, ob der Anlaufvorgang [...] unter der Beteiligung von Luftsauerstoff abläuft."
Anschließend wird den Schüler(innen) eine Tabelle mit den "hier zu vermutenden Teilreaktionen" präsentiert:

Behandlung von angelaufenen Silber im Labor
In diesem Material wird den Schüler(innen) folgendes mitgeteilt:
Silberbleche, die im Labor verwendet werden, laufen ebenfalls mit der Zeit an. Es gibt da nun einen alten Labortrick: Wenn man ein angelaufenes Silberblech in die nichtleuchtende Bunsenflamme hält, wird dieses wieder blank.
Reinigen von angelaufenem Silberbesteck
In diesem Material werden zwei Haushalts-Methoden zur Reinigung von angelaufenem Silberbesteck vorgestellt, die Zahnpasta-Methode und die Aluminium-Salz-Methode.
Zahnpasta-Methode: Das Besteck wird mit Zahnpasta eingerieben. Es bildet sich eine Silbersulfid-Schicht (Ag2S), die dann durch Reiben mechanisch abgetragen wird. Anschließend wird das Besteck mit Wasser gereinigt.
Aluminium-Salz-Methode: Man gibt in eine Schüssel warmes Wasser mit mehreren Teelöffeln Kochsalz und ein wenig Essig. Dann wickelt man das Silberbesteck in Aluminiumfolie ein und legt es für 10 Minuten in das Salzwasser. Die Ag+-Ionen werden dabei wieder in Ag-Atome umgewandelt, während die S2--Ionen zunächst zu HS--Ionen reagieren und dann zu H2S-Molekülen.
Nach dem Herausnehmen des eingewickelten Bestecks sieht man kleine Löcher in der Aluminiumfolie, und man nimmt den Geruch von Schwefelwasserstoff wahr, was nicht ganz ungefährlich ist, da H2S ein starkes Gift ist.
Zusatzinformationen
Als Zusatzinformationen werden die Faraday-Konstante, das Faraday-Gesetz, die molare Masse von Silber sowie die Standardpotenziale der beteiligten Stoffe angegeben.
Auf dieser Seite ist das wichtige Gesetz ausführlich erläutert. Es wird dabei auch auf diese Abituraufgabe Bezug genommen.
2. Aufgabenstellung Grundkurs
Aufgabe 1
- Die in Versuch a) gemachten Beobachtungen sollen mit Hilfe von Reaktionsgleichungen erläutert werden. Dann soll die Masse an Silber, die sich bei dem Versuch b) abscheidet, berechnet werden (12 Punkte)
- Schließlich soll begründet werden, warum es bei Versuch b) besser ist, ein Silberblech als Anodenmaterial zu verwenden statt Graphit. Untermauert werden soll die Begründung mit Reaktionsgleichungen (6 Punkte)
- Am Ende von Aufgabe 1 sollen die S. beurteilen, "ob es sinnvoller ist, Gegenstände galvanisch zu versilbern, anstatt sie lediglich in eine Silbersalz-Lösung zu legen." (6 Punkte)
Aufgabe 2
- Hier sollen die Beobachtungen erklärt werden, die man macht, wenn man ein angelaufendes Silberblech in die nichtleuchtende Flamme eines Bunsenbrenners hält (2 Punkte)
- Anschließend sollen die Aussagen der beiden Zitate zum Anlaufen von Silber beurteilt werden. Dabei soll davon ausgegangen werden, dass die in den Zitaten erwähnten Reaktionen für das Anlaufen verantwortlich sind (12 Punkte)
Aufgabe 3
- Die S. sollen einen Versuchsaufbau der Aluminium-Salz-Methode zeichnen (4 Punkte)
- Dann sollen die elektrochemischen Vorgänge erläutert werden, die bei dieser Methode ablaufen (8 Punkte)
- Schließlich sollen die beiden Reinigungsmethoden verglichen werden (Vor- und Nachteile) (10 Punkte).
3. Leistungskurs-Version
Die LK-Version der Aufgabe ist etwas umfangreicher als die GK-Version.
Materialien
Die gleichen wie bei der GK-Version, aber zusätzlich wird die Nernst-Gleichung für Sauerstoff-Halbzellen angegeben:
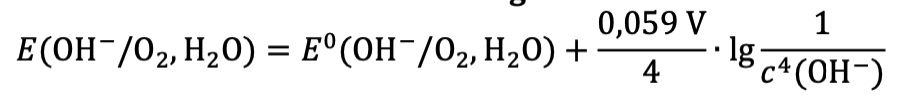
Aufgabenstellung
Aufgabe 1
Diese Aufgabe ist fast identisch mit der GK-Aufgabe. Die Teilaufgabe 3 entfällt allerdings, und daher gibt es auch nur 18 Punkte für diese Aufgabe.
Aufgabe 2
- Die S. sollen hier die Spannung berechnen, die "mindestens aufgebracht werden muss, um einen Gegenstand nach Experiment c) zu versilbern". (4 Punkte)
- Mit Hilfe der Nernst-Gleichung soll außerdem erläutert werden, welchen Einfluss die Hydroxid-Ionen-Konzentration auf die notwendige Spannung hat (6 Punkte)
- Schließlich sollen die S. beurteilen, "ob es sinnvoller ist, Gegenstände galvanisch zu versilbern, anstatt sie lediglich in eine Silbersalz-Lösung zu legen." (6 Punkte)
Aufgabe 3
Diese Aufgabe ist identisch mit der Aufgabe 2 der GK-Version.
Aufgabe 4
Diese Aufgabe ist identisch mit der Aufgabe 3 der GK-Version.