Einordnung
Diese Abituraufgabe von 2021 kreist vor allem um das Thema Elektrochemie, vor allem werden galvanische Elemente behandelt. In der LK-Version sind auch Kenntnisse der Redoxchemie gefragt.
Zur Aufgabenstellung
In dieser Abituraufgabe aus dem Bereich der Elektrochemie geht es um das galvanische Element, das im Jahre 1839 von William Grove entwickelt wurde, das sogenannte Grove-Element.
Materialien:
Den Schüler(innen) werden folgende Materialien ("fachspezifische Vorgaben") zur Verfügung gestellt:
Material 1
Text und Abbildung zum historischen Grove-Element.
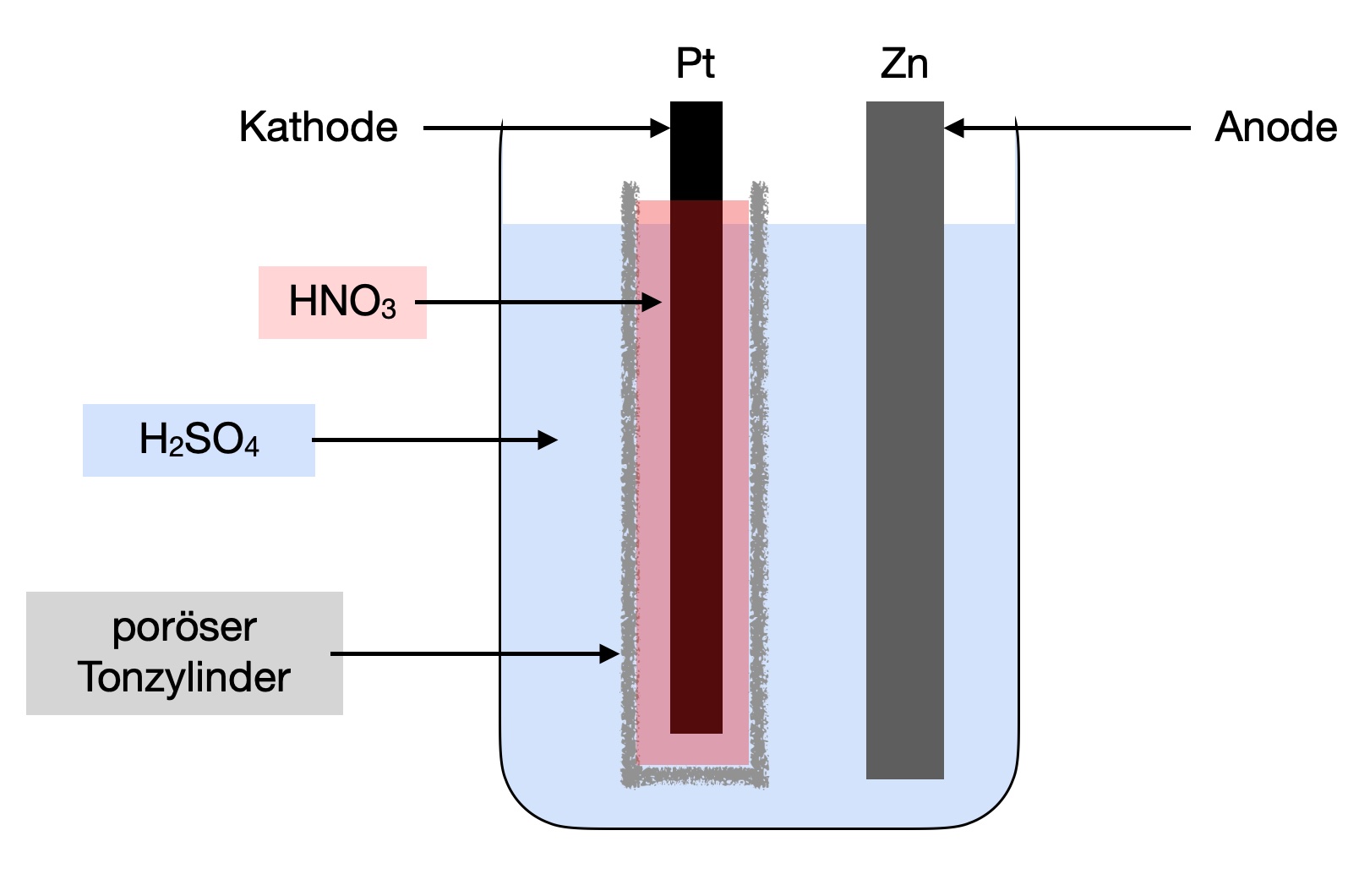
Schematischer Aufbau des Grove-Elementes
Autor: Ulrich Helmich 05/2024, Lizenz: Public domain
Eine Beschreibung dieses galvanischen Elementes finden Sie in dem entsprechenden Lexikon-Artikel auf dieser Homepage.
In dem Material findet sich außerdem die Reaktion in der Platin-Halbzelle:
$NO_3^{-} + 2 \ H_3O^{+} + e^{-}\to NO_2 + 3 \ H_2O$
Auf die Reaktion in der Zink-Halbzelle müssen die Schüler(innen) von selbst kommen.
Mit einem nachgebauten Grove-Element wurde die Massenabnahme des Zinkblechs während des Betriebs ermittelt. Das Zinkblech hatte zu Beginn des Versuchs eine Masse von 45,00 g, nach vollständiger Entladung über einen Verbraucher wog das Zinkblech aber nur noch 26,04 g.
Material 2
Hier wird ein Modellexperiment vorgestellt, das eine moderne Version des Grove-Elementes darstellen soll. Die Zink-Elektrode befindet sich ähnlich wie beim Grove-Element in verdünnter Schwefelsäure, statt der Platin-Elektrode wird aber eine Kohle-Elektrode verwendet, und die steht auch nicht in verdünnter Salpetersäure, sondern in einer schwefelsauren Kaliumperoxodisulfat-Lösung (K2S2O8). Statt des porösen Tonzylinders, der alle Ionen durchlässt, wird eine Membran verwendet, die nur Kationen durchlässt, nicht aber Anionen.
Zusatzinformationen
In den Zusatzinformationen auf Seite 3 wird die molare Masse von Zink angegeben(65,38 g/mol), außerdem das Faradaysche Gesetz:
$Q = I * t = n *F * z$
Die Faraday-Konstante wird mit F = 96485 A•s•mol-1 angegeben.
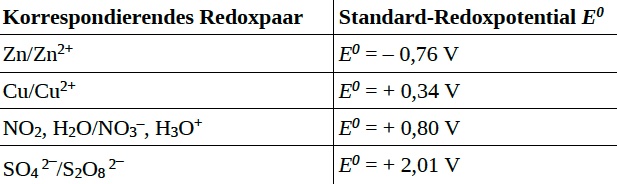
Schließlich findet sich in den Zusatzinformationen eine kleine Tabelle mit Redoxpotenzialen unter Standardbedingungen:
Eine zweite Tabelle gibt eine kurze Übersicht über die Gefahren, die von den einzelnen Komponenten des Grove-Elementes bzw. des Modellversuchs ausgehen.
Die einzelnen Aufgaben
Aufgabe 1
a) Beschreibung des Grove-Elementes und der ablaufenden Prozesse
b) Berechnung der Spannung unter Standardbedingungen
c) Berechnung der geflossenen Ladungsmenge Q während des Modellversuchs.
Aufgabe 2
a) Die elektrochemischen Prozesse beim Betrieb des Grove-Elementes sollen mit Hilfe der Teilreaktionen (Reduktion, Oxidation) angegeben werden.
b) Es soll begründet werden, warum bei dem Modellversuch sich das Kupferblech in der Salpetersäure zersetzt.
Aufgabe 3
a) Die Versuchsanordnung des Modellversuchs soll daraufhin überprüft werden, ob es sich als galvanisches Element überhaupt eignet.
b) Die elektrochemischen Prozesse und die Ionenbewegungen beim Stromfluss sollen schematisch in einer Skizze dargestellt werden.
c) Es soll beurteilt werden, ob sich die moderne Version des Grove-Elementes (Modellversuch) für einen praktischen Einsatz eignet, dabei soll auch auf die Umwelteigenschaften sowie auf die Störanfälligkeit eingegangen werden.
LK-Version
Die LK-Version ähnelt der oben dargestellten GK-Version, allerdings wird neben dem Grove-Element das Bunsen-Element behandelt, das eine Weiterentwicklung des Grove-Elements ist.
Während in der GK-Version nur ein einfacher Versuch sowie ein Modellexperiment in den Materialien zu finden ist, wird das Material für den LK um einen zweiten Versuch ergänzt, der etwas komplexer ist.
Als Elektrolyt wird eine Kaliumdichromat-Lösung verwendet, die mit Schwefelsäure angesäuert und außerdem mit Chrom(III)-Ionen versetzt ist. In einer alternativen Version dieses Versuchs wird die Schwefelsäure durch Bromwasserstoffsäure ersetzt. Hier färbt sich die Lösung dann braun, und es ist ein Bromgeruch wahrnehmbar. In der Teilaufgabe 2 und 3 sollen dann die Beobachtungen dieses zweiten Versuchs (mit Schwefelsäure / mit Bromwasserstoffsäure) erklärt werden.