Das Orbitalmodell ist hilfreich bei der Organischen Chemie
Wann wird das Orbitalmodell im Oberstufenunterricht gebraucht? Es könnte sich bei vier Themen der Organischen Chemie als nützlich erweisen:
- Struktur der C=C-Doppelbindung
- Aromatizität des Benzol-Moleküls
- Bau von Carbenium-Ionen und C-Radikalen
- Pentavalenter Übergangszustand bei der SN2
Allerdings benötigen Sie dazu keine detaillierten Kenntnisse des Orbitalmodells und der verschiedenen Hybridisierungen des C-Atoms, sondern eigentlich müssen Sie nur den Unterschied zwischen sp3- und sp2-hybridisierten C-Atomen kennen. Diese wichtige Unterschied soll Ihnen auf dieser Seite beigebracht werden.
Die beiden wichtigen Zustände des C-Atoms
sp3-Hybridisierung
Der "normale" Zustand des C-Atoms, den Sie bereits in der Stufe 9 kennengelernt haben, wird im Orbitalmodell als sp3-Hybridisierung bezeichnet. Man spricht dann auch von sp3-hybridisierten C-Atomen. Das ist eigentlich nichts anderes als das Kugelwolkenmodell des C-Atoms: Der Atomkern und die Elektronen der inneren K-Schale werden als "inneres Atom" zusammengefasst, und die vier Elektronen der L-Schale werden auf vier Kugelwolken verteilt, die tetraedrisch um das innere Atom gruppiert sind. Nur werden die Kugelwolken nicht mehr als "Kugelwolken" bezeichnet, sondern als "Orbitale", genauer gesagt, als "sp3-Hybridorbitale".
sp2-Hybridisierung
In diesem Zustand sieht das Kohlenstoff-Atom völlig anders aus. Das "innere Atom" bleibt unverändert, aber die vier Außenelektronen verteilen sich anders. Es gibt nämlich drei sogenannte sp2-Hybridorbitale, die alle in einer Ebene liegen. Die Winkel zwischen diesen drei Orbitalen betragen nicht mehr 109 Grad wie bei der tetraederförmigen Anordnung, sondern 120 Grad. Jedes dieser drei sp2-Hybridorbitale ist mit einem Elektron besetzt.
Und wo bleibt das vierte Elektron des C-Atoms?
Das vierte Elektron ist ein einem besonderen Orbital untergebracht, das als p-Orbital (genauer: pz-Orbital) bezeichnet wird. Am besten schaut man sich mal eine Zeichnung an, dann versteht man das Ganze besser:
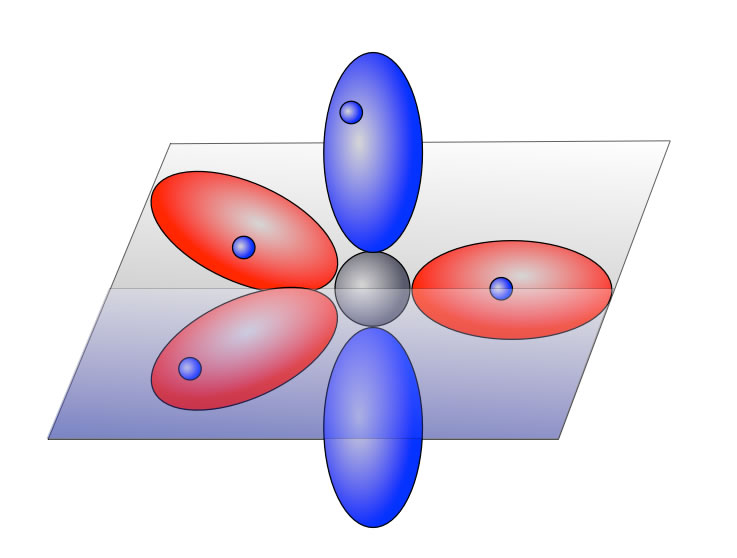
Hier sehen wir ein sp2-hybridisiertes C-Atom. Die drei sp2-Hybridorbitale sind rot gezeichnet, das eine p-Orbital blau. Wie man sieht, besteht das p-Orbital aus zwei Hälften, den sogenannten Orbital-Lappen. Trotzdem enthält das p-Orbital nur ein Elektron, das sich mit gleicher Wahrscheinlichkeit in beiden Lappen aufhalten kann.
Was kann man nun damit anfangen?
C=C-Doppelbindung
Betrachten wir als erstes die C=C-Doppelbindung. Nach dem Kugelwolkenmodell müssten ja eigentlich beide Bindungen gleichwertig sein. Dies entspricht aber nicht den Tatsachen. Die Doppelbindung besteht aus einer recht starken kovalenten Bindung, die auch als sigma-Bindung bezeichnet wird, und einer vergleichsweise schwachen Bindung, die man auch pi-Bindung nennt. Das Kugelwolkenmodell kann diese beiden verschiedenen Bindungsarten nicht erklären, das Orbitalmodell schon. Betrachten dazu einmal eine Zeichnung des Ethen-Moleküls:
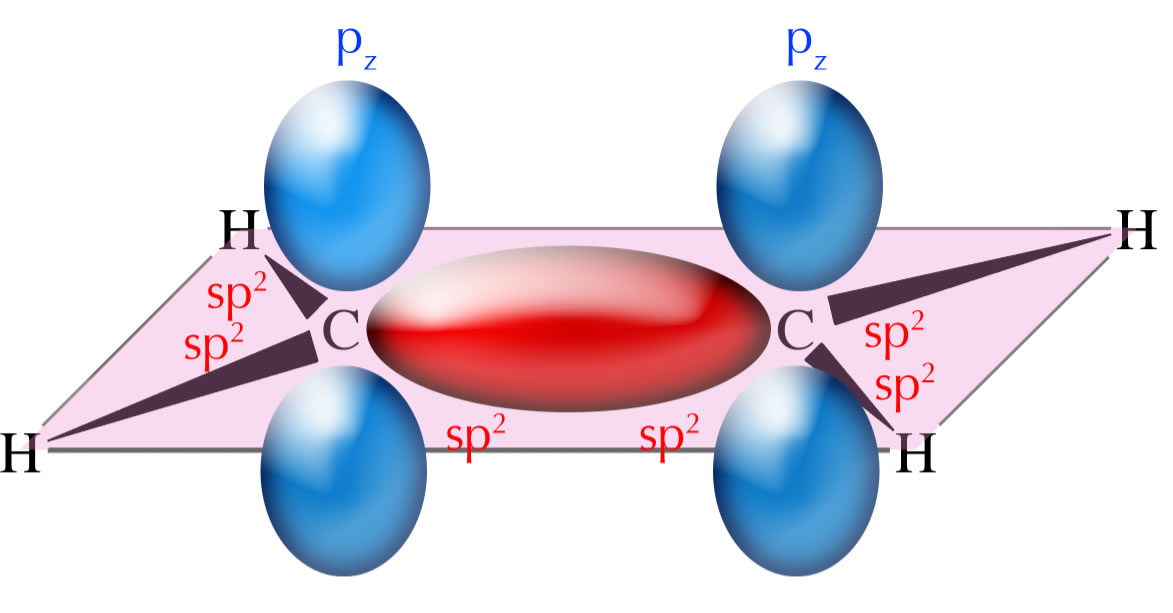
Beide C-Atome des Ethens sind sp2-hybridisiert. Die sp2-Orbitale sind für die kovalenten Bindungen zuständig. Jedes C-Atom ist mit zwei H-Atomen verbunden und mit dem anderen C-Atom. Bei den C-H-Bindungen überlappt je ein sp2-Orbital mit der Elektronenwolke eines H-Atoms. Bei der sigma-Bindung zwischen den beiden C-Atomen überlappen die beiden restlichen sp2-Orbitale. Die p-Orbitale stehen senkrecht zu der eingezeichneten Ebene.
Betrachten wir das nächste Bild:
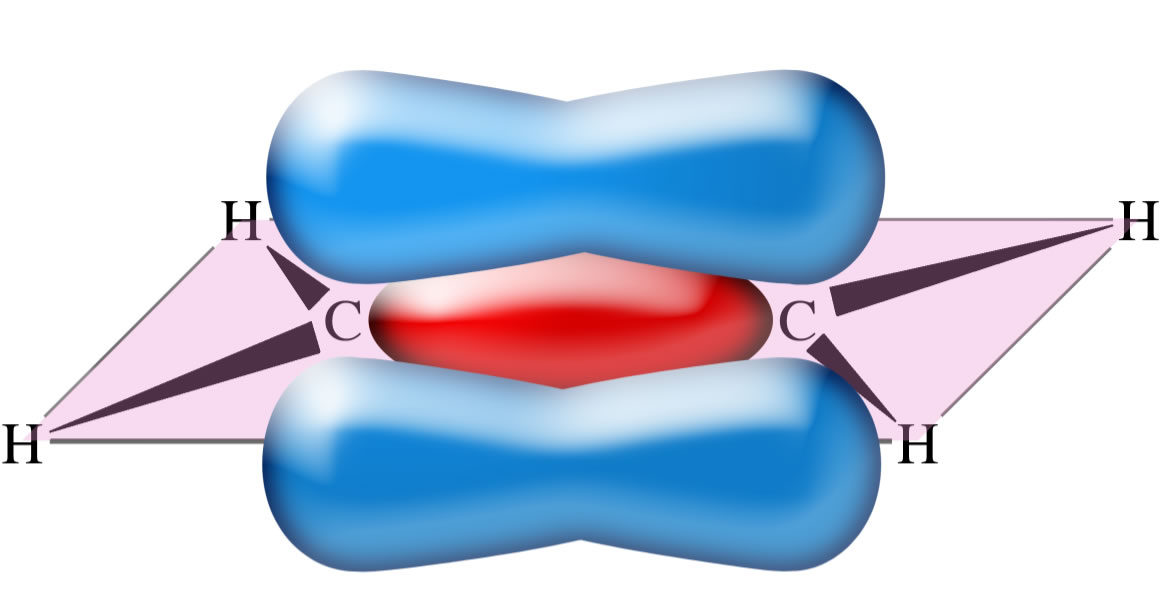
Hier überlappen die beiden p-Orbitale und bilden die pi-Bindung. Die Wahrscheinlichkeit, dass sich ein Elektron zwischen den beiden Atomkernen aufhält, ist nicht allzu groß. Die beiden p-Orbitale müssen sich nämlich ziemlich stark "verbiegen", damit es überhaupt zu einer Überlappung kommt. Entsprechend schwach ist die pi-Bindung.
Mit diesem Modell wird aber gut erklärt, wieso die C=C-Doppelbindung aus einer starken Bindung und einer schwachen Bindung besteht. Das Kugelwolkenmodell scheitert daran.
Aromatischer Zustand
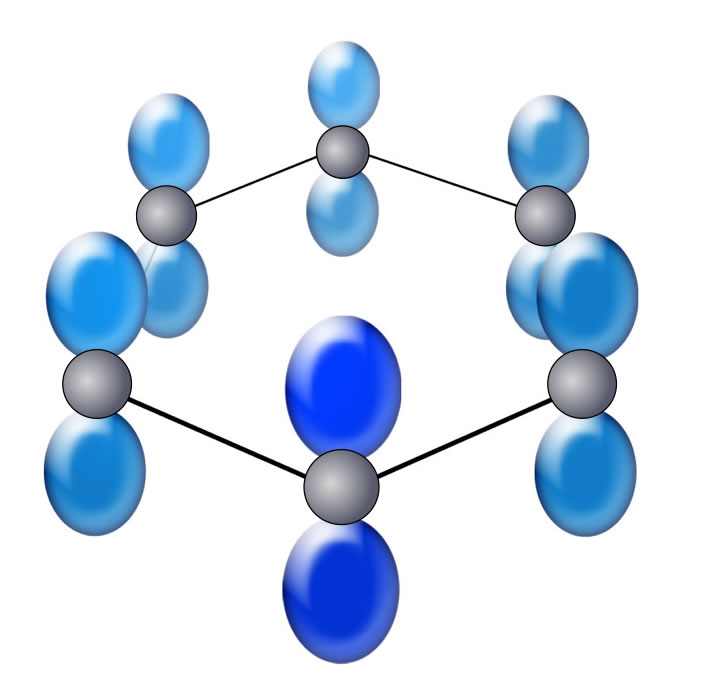
Hier sehen wir das Benzol-Molekül mit seinen sechs C-Atomen. Jedes dieser sechs C-Atome ist sp2-hybridisiert. Die sechs p-Orbitale befinden sich oberhalb und unterhalb der Ringebene und überlappen - was man auf dieser Abbildung noch nicht sieht. Die sechs Elektronen dieser p-Orbitale können sich nun in dem gesamten Bereich, der durch die Überlappung gebildet wird, aufhalten. Diese pi-Elektronen sind delokalisiert. Dieser Zustand ist besonders stabil (energetisch günstig), was aber auf den Seiten über den aromatischen Zustand näher erklärt wird.
Carbenium-Ionen und C-Radikale
Carbenium-Ionen, wie sie beispielsweise bei der SN1-Reaktion auftreten (siehe dort), sind planar. Das C-Atom ist nur mit drei weiteren Atomen verbunden und trägt eine positive Ladung. Mit dem Kugelwolkenmodell kann man diesen planaren Zustand nicht erklären, wohl aber mit dem Orbialmodell. Offensichtlich ist das C-Atom im Carbenium-Ion sp2-hybridisiert. Die drei Substituenten des C-Atoms sind an die drei sp2-Orbitale gebunden und liegen auf einer Ebene, und das p-Orbital ragt nach oben und nach unten aus dieser Ebene heraus. Allerdings enthält dieses p-Orbital kein Elektron.
Bei einem C-Radikal ist das fast genau so, nur mit dem Unterschied, dass das p-Orbital ein Elektron besitzt.
Pentavalenter Übergangszustand
Bei der SN2-Reaktion (siehe dort) bildet sich ein pentavalenter Übergangszustand. Die Abgangsgruppe ist noch an das C-Atom gebunden, und das Nucleophil bildet bereits eine Bindung zum C-Atom. Außerdem ist das C-Atom mit drei weiteren Atomen verknüpft, so dass sich insgesamt fünf Bindungen ergeben, daher die Bezeichnung "pentavalent" (fünfwertig).
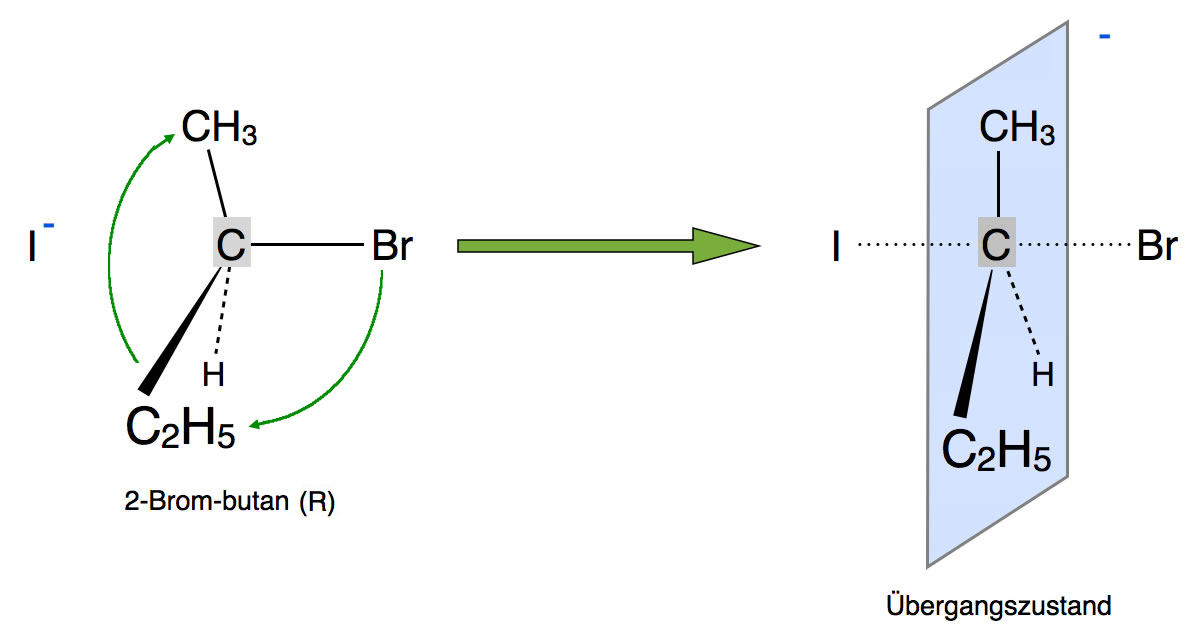
Hier sehen wir einen solchen fünfwertigen Übergangszustand. Mit dem Kugelwolkenmodell kann man einen solchen Übergangszustand nicht erklären, mit dem Orbitalmodell schon. Die Bindungen zu den drei Alkylgruppen bzw. zum H-Atom werden mit den sp2-Orbitalen hergestellt. Die beiden Lappen des p-Orbitals überlappen mit dem Nucleophil (hier links von der Ebene) und gleichzeitig mit der Abgangsgruppe (rechts der Ebene).