Ein Radikal ist ein Teilchen (Atom, Molekül, Ion) mit einem ungepaarten Elektron[1]. Nach dem Kugelwolkenmodell handelt es sich also um Teilchen, die eine Kugelwolke haben, die mit nur einem Elektron besetzt ist.
Radikale sind in der Regel chemisch höchst reaktiv und damit Auslöser für viele Reaktionen, zum Beispiel die Radikalische Substitution. Allerdings gibt es auch relativ stabile Radikale wie zum Beispiel Stickstoffmonoxid *NO oder Stickstoffdioxid *NO2. Der Römpp[1] nennt DPPH (2,2-Diphenyl-1-picrylhydrazyl) als stabiles Radikal, das sogar bei Zimmertemperatur unbegrenzt haltbar ist.
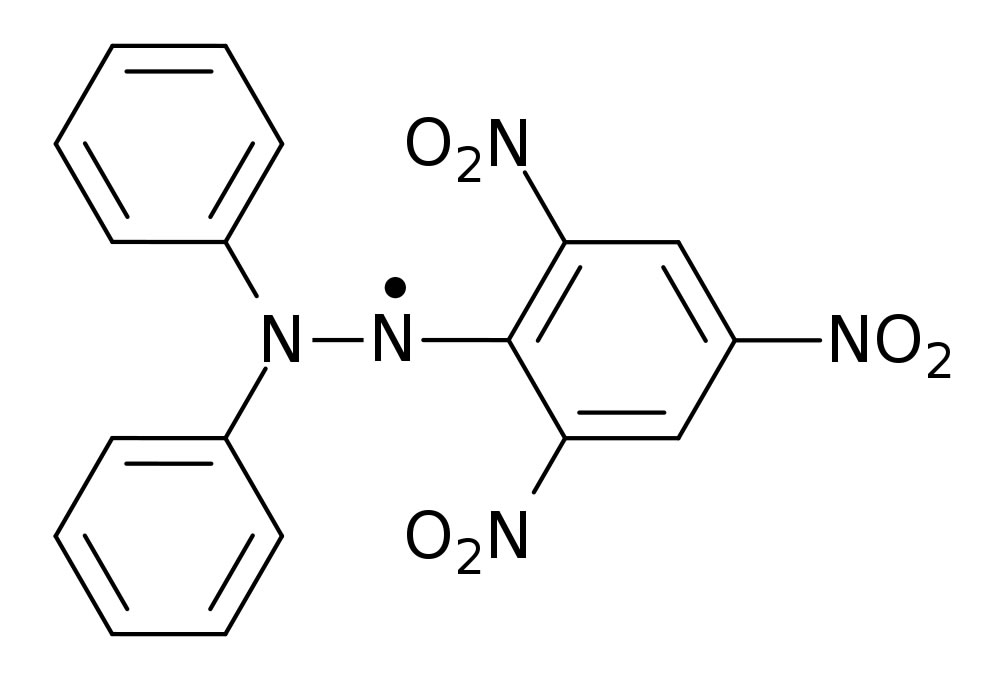
Das DPPH-Radikal
Die Verbindung DPPH ist ein schwarzgrünes Pulver mit einem Schmelzpunkt von 135 ºC[2]. Weitere bei Zimmertemperatur stabile Radikale siehe "Radikale, stabile" in diesem Lexikon.
Bildung von Radikalen
Es gibt mehrere Möglichkeiten, wie Radikale entstehen können. Aus dem Chemieunterricht kennen Sie bestimmt die durch Licht verursachte Homolyse eines Br2-Moleküls (Photolyse), bei der zwei Brom-Radikale entstehen. Das so gebildete Brom-Radikal kann dann ein H-Atom aus einem Alkan abstrahieren, dabei wird eine kovalente C-H-Bindung homolytisch getrennt. Damit haben wir bereits zwei Möglichkeiten der Radikalbildung kennengelernt.
Eine dritte Möglichkeit ist die Addition eines Radikals an eine Doppel- oder Dreifachbindung, dabei entsteht dann ein neues, größeres Radikal. Diese Reaktion spielt beispielsweise bei radikalischen Additionen oder Polymerisationen eine wichtige Rolle.
Diese und weitere Möglichkeiten der Radikal-Bildung werden auf der Lexikonseite "Radikale, Bildung" näher beschrieben.
Alkylradikale
Für die organische Chemie sind die Alkylradikale besonders wichtig. Formal handelt es sich dabei um Alkane, denen ein Wasserstoff-Atom abstrahiert (entfernt) wurde. Besonders leicht bilden sich tertiäre Radikale (mit einem radikalischen tertiären C-Atom), weil diese durch Hyperkonjugation sowie durch andere Faktoren besonders gut stabilisiert werden. Sekundäre Radikale bilden sich nicht so leicht, primäre noch weniger.
Radikalische Reaktionen
Die für den Chemie-Unterricht wichtigste radikalische Reaktion ist die radikalische Substitution, zum Beispiel die Bromierung von Hexan oder die Chlorierung von Ethan. Wie eine solche Reaktion abläuft, ist im Abschnitt "Radikalische Substitution" auf dieser Homepage ausführlich erklärt.
Auch bei der Herstellung bestimmter Kunststoffe werden radikalische Reaktionen eingesetzt, man spricht dann von einer radikalischen Polymerisation. Siehe dazu den entsprechenden Abschnitt in der Abteilung für Kunststoffchemie auf dieser Homepage.
Normalerweise nicht im Chemie-Unterricht der S II behandelt wird die radikalische Addition, die eine Anti-Markownikow-Anlagerung von Teilchen ermöglicht.
Radikale in biologischen Systemen
In lebenden Zellen haben Radikale wegen ihrer hohen Reaktivität nichts zu suchen, daher gibt es im Körper jede Menge chemischer Substanzen, die als Radikalfänger oder Radikalhemmer bekannt sind. Vitamin C ist neben Vitamin E der wohl bekannteste dieser Radikalfänger. Diese Verbindung ist wasserlöslich und reagiert mit Radikalen im Zellplasma oder im Blut. Vitamin E ist ein fettlösliches Vitamin, das Radikale in der Zellmembran abfängt.
Am Beispiel des Hydrochinons soll gezeigt werden, wie ein solcher Radikalfänger funktioniert:
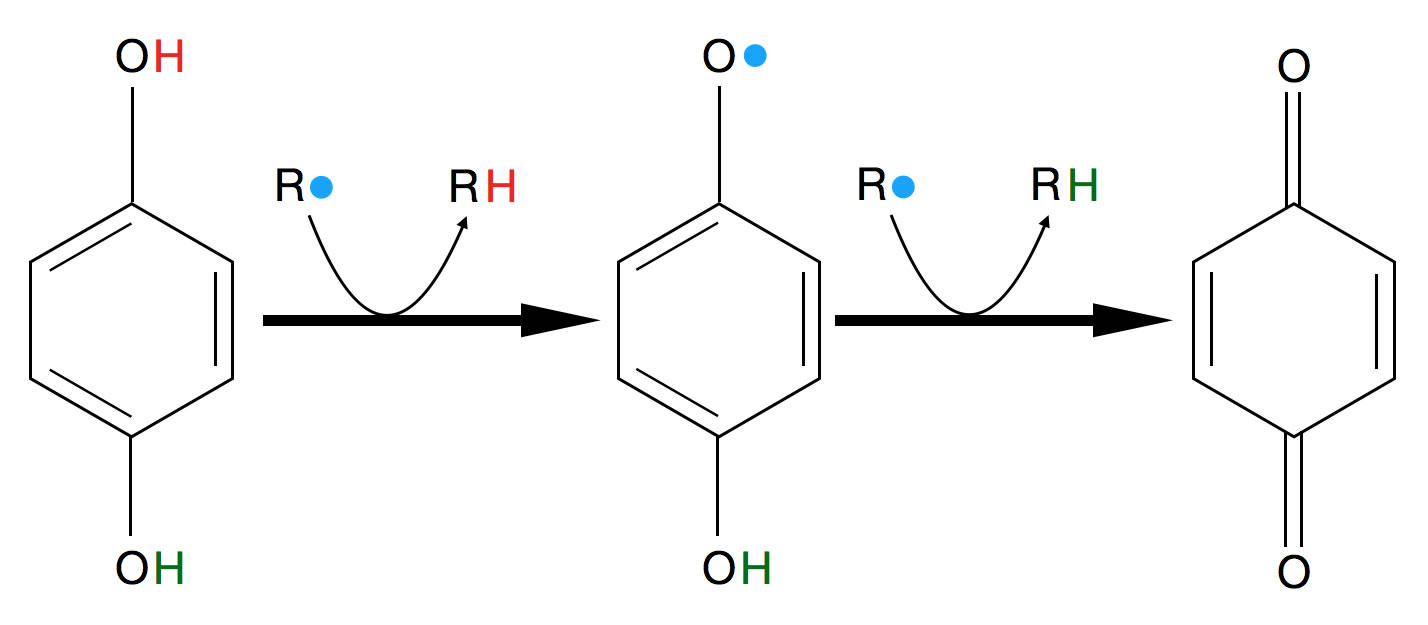
Hydrochinon als Radikalfänger
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz
Durch Reaktion von Hydrochinon (links) mit einem Radikal R* bildet sich zunächst Semichinon (Mitte), das selbst ein Radikal ist. Dieses Radikal wird aber durch die Delokalisierung der Elektronen stabilisiert, so dass es nicht mehr so reaktiv ist wie das abgefangene Radikal R*. Wenn das Semichinon dann ein zweites Radikal abfängt, entsteht das harmlose Chinon (rechts).
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- engl. Wikipedia, Artikel DPPH, Zugriff am 04.02.2019
- Kurt Peter C. Vollhardt, Neil Eric Schore: Organische Chemie, John Wiley & Sons, 2011, S. 627f.
- Wikipedia, Artikel Einelektronenübertragung, Zugriff am 04.02.2019
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.