Und weiter geht es in der Reaktionskette
Halogenalkane sind Alkane, bei denen ein oder mehrere Wasserstoff-Atome durch Halogen-Atome ersetzt worden sind. Die Halogenalkane werden oft auch als Alkylhalogenide bezeichnet, so zum Beispiel im Römpp Chemie-Lexikon[1].
Neben monosubstituierten Halogenalkanen wie zum Beispiel Chorethan gibt es auch mehrfach-substituierte Halogenalkane wie Trichlormethan (Chloroform). Halogenalkane können auch verschiedene Halogene enthalten, beispielsweise Fluor und Chlor gleichzeitig (FCKWs = Fluor-Chlor-Kohlenwasserstoffe).
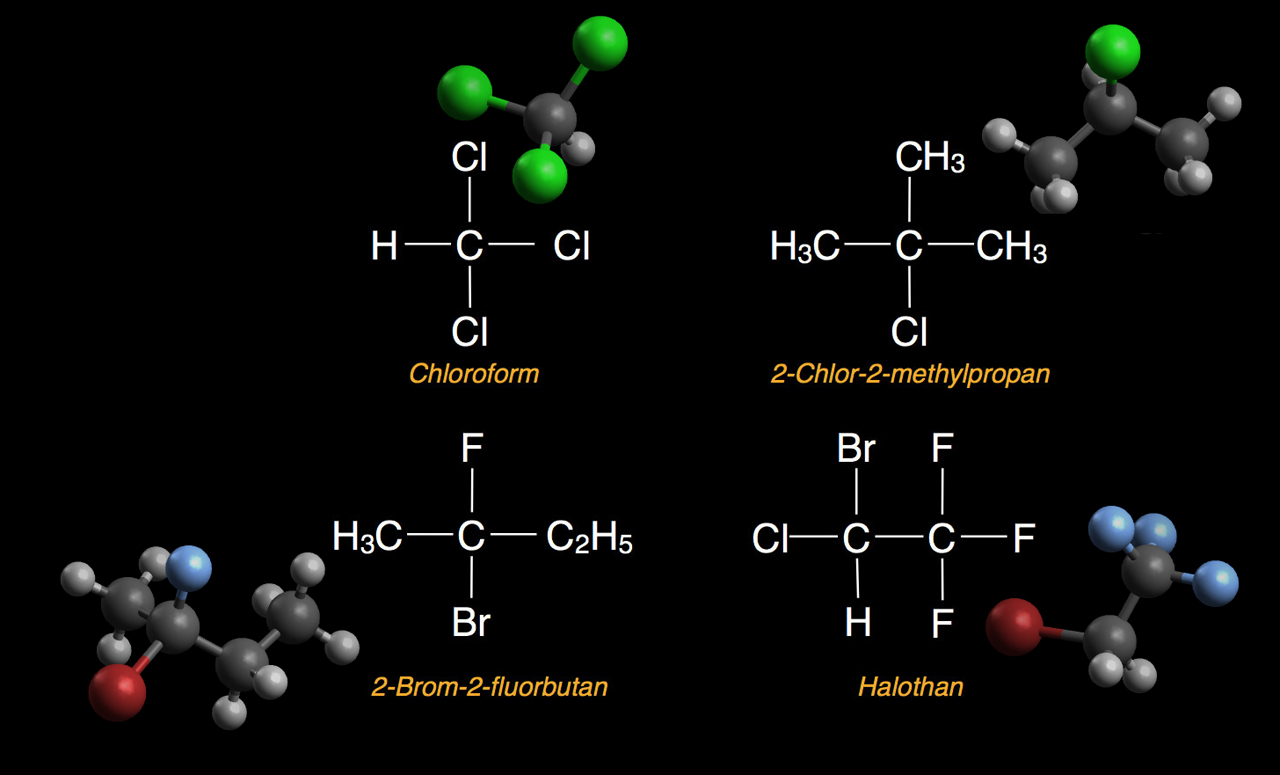
Einige Halogenalkane: Chloroform, 2-Chlor-2-methylpropan, 2-Brom-2-fluorbutan, Halothan
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Das Bild oben zeigt vier typische Halogenalkane als Strukturformel und als Molekülmodell.
Die C-X-Bindung
Halogenalkane unterscheiden sich von den Alkanen durch den Besitz von Halogen-Atomen (Fluor, Chlor, Brom oder Iod). Halogene sind elektronegativer als Kohlenstoff-Atome, daher ist die C-X-Bindung grundsätzlich polarisiert mit einem negativen Ladungsschwerpunkt am Halogen-Atom und einem positiven Ladungsschwerpunkt am Kohlenstoff-Atom der C-X-Bindung. Die Stärke der Polarisierung hängt von dem Elektronegativitäts-Unterschied zwischen dem C-Atom und dem Halogen-Atom ab. Bei der C-F-Bindung ist dieser EN-Unterschied am größten, bei der C-I-Bindung am geringsten. Die C-F-Bindung ist daher sehr stark polarisiert, die C-I-Bindung nur noch sehr schwach.
Streng genommen, ist die C-I-Bindung unpolar, denn sowohl Kohlenstoff wie auch Iod haben eine Elektronegativität von 2,5 - der EN-Unterschied ist also gleich Null.
EN-Unterschiede der C-X-Bindung
- C-F: 2,5-4,0 = -1,5
- C-Cl: 2,5-3,0 = -0,5
- C-Br: 2,5-2,8 = -0,3
- C-I: 2,5-2,5 = 0
Die Polarität der C-X-Bindung hat Auswirkungen sowohl auf die physikalischen wie auch auf die chemischen Eigenschaften der Halogenalkane.
Physikalische Eigenschaften
Siedepunkt, Schmelzpunkt und Dichte
Wegen der polaren C-X-Bindung, die den Halogenalkan-Molekülen einen mehr oder weniger starken permanenten Dipol-Charakter verleiht, sind die Siedepunkte, Schmelzpunkte und Dichten grundsätzlich höher als bei den entsprechenden Alkanen. So hat Butan einen Siedepunkt von 0,5 ºC, 1-Chlorbutan dagegen siedet bei 78 ºC. Allerdings ist dieser Siedepunkt niedriger als der von Butan-1-ol mit 117,7 ºC. Das wiederum liegt daran, dass die Halogenalkane keine Wasserstoffbrücken-Bindungen untereinander eingehen können, während die Alkohole das ja können.
Das Chlor- oder Brom-Atom könnte zwar theoretisch als H-Brücken-Akzeptor fungieren, allerdings besitzen die Halogenalkane keine H-Brücken-Donatoren, also keine H-Atome, die an elektronegativen Atomen wie O oder N gebunden sind.
- Die Schmelzpunkte, Siedepunkte und Dichten der Halogenalkane sind wegen des Dipol-Charakters höher als die der entsprechenden Alkane und wegen fehlender H-Brücken niedriger als die der entsprechenden Alkohole.
- Die Schmelzpunkte, Siedepunkte und Dichten der Halogenalkane steigen mit wachsender Kettenlänge, wie bei jeder homologen Reihe der organischen Verbindungen.
Aufgabe
Erläutern Sie, welchen Einfluss die Art des Halogen-Atoms auf den Siedepunkt eines Halogenalkans hat.
Diese Aufgabe wollen wir gemeinsam lösen, weil Sie während der gemeinsamen Lösung einige neue Sachverhalte kennen lernen.
Lösung dieser Aufgabe
und Einführung zweier neuer Kräfte
Zunächst wird man wahrscheinlich denken, das Fluor die größte Elektronegativität aller Elemente hat, was ja auch stimmt. Die C-F-Bindung sollte also extrem polar sein, auch das ist korrekt. Daraus müsste sich dann die Schlussfolgerung ergeben, dass beispielsweise Fluormethan einen viel höheren Siedepunkt hat als Iodmethan.
Das Gegenteil ist aber der Fall. Der Siedepunkt von Fluormethan beträgt -78 ºC, der von Iodmethan aber +43 ºC.
In der Schule erklärt man diese Tatsache oft mit der großen Masse des Iod-Atoms. Weil das Iod-Atom eine so große Masse hat, ist der Siedepunkt von Iodmethan so hoch.
Auf den ersten Blick leuchtet diese Argumentation vielleicht ein, aber bei näherer Betrachtung führt sie nicht weiter. Nicht die hohe molare Masse von Iod ist der entscheidende Faktor, sondern die leichte Polarisierbarkeit des Iod-Atoms.
Polarisierbarkeit von Atomen und London-Kräfte
Unter Polarisierbarkeit versteht man das Phänomen, dass man die Elektronenhülle eines Atoms quasi verformen kann, wenn von außen eine elektrische Ladung auf das Atom einwirkt.
Dazu betrachten wir die nächste Abbildung:
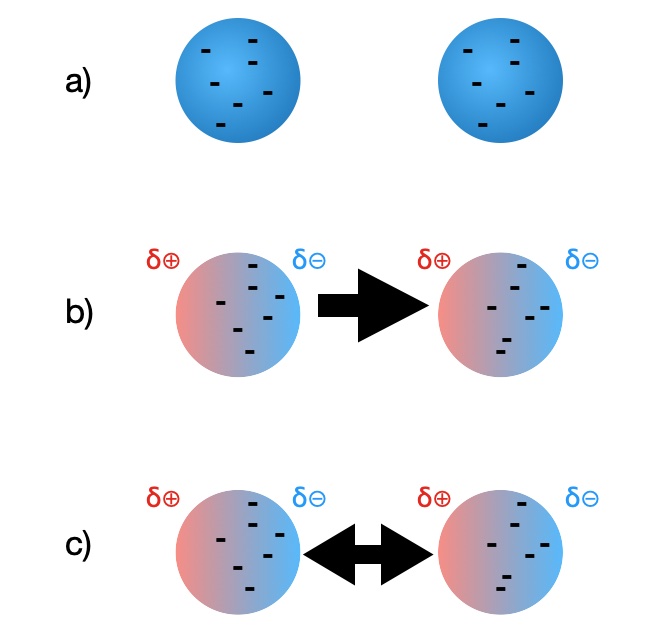
Polarisierung eines Atoms
Autor: Ulrich Helmich 04/2025, Lizenz: Public domain
a) zwei elektrisch neutrale Iod-Atome mit den Außenelektronen
b) die Außenelektronen des linken Atoms befinden sich durch ihre permanente Bewegung zufällig einmal gleichzeitig auf der rechten Seite der Elektronenhülle. Dadurch wird das Iod-Atom zu einem temporären Dipol. Das elektrische Feld dieses temporären Dipols induziert (bewirkt) nun, dass die Elektronen des benachbarten Iod-Atoms abgestoßen werden und sich ebenfalls auf die rechte Seite der Hülle bewegen. Diesen Vorgang bezeichnet man als Polarisierung.
Aus diesem neutralen Iod-Atom ist ebenfalls ein temporärer Dipol entstanden, den man aber als induzierten Dipol bezeichnet, weil er nicht von selbst entstanden ist, sondern durch den temporären Dipol auf der linken Seite induziert wurde.
c) Wir haben jetzt zwei temporäre Dipole (der linke spontan entstanden, der rechte vom linken induziert), die sich gegenseitig anziehen. Diese schwache Anziehungskraft bezeichnet man als London-Kraft. London-Kräfte gehören zu den van-der-Waals-Kräften.
Iodalkane haben also nicht wegen der hohen Masse des Iod-Atoms einen hohen Siedepunkt, sondern wegen der leichten Polarisierbarkeit des großen Iod-Atoms und den daraus resultierenden großen London-Kräften.
Ergänzt werden die London-Kräfte durch die Keesom-Kräfte, die ebenfalls zu den van-der-Waals-Kräften gehören. In der Schule werden Keesom-Kräfte meistens als "Dipol-Dipol-Kräfte" bezeichnet. Keesom-Kräfte herrschen zwischen permanenten Dipolen. Und wegen der hohen Elektronegativität der Halogen-Atome sind die Moleküle der Halogenalkane stark polar und daher permanente Dipole.
Wasserlöslichkeit
Die Wasserlöslichkeit der Halogenalkane ist sehr gering, aber immer noch deutlich höher als bei den entsprechenden Alkanen:
- Pentan: Wasserlöslichkeit = 39 mg / l Wasser
- 1-Chlorpentan: Wasserlöslichkeit = 200 mg / l Wasser
- 1-Pentanol: Wasserlöslichkeit = 22.000 mg / l Wasser
Das Chlorpentan ist also fast fünfmal besser wasserlöslich als das bei Zimmertemperatur ebenfalls flüssige Pentan. Allerdings ist der entsprechende Alkohol 1-Pentanol über 100 mal besser wasserlöslich als 1-Chlorpentan.
Offensichtlich hat die polare C-X-Bindung einen Einfluss auf die Wasserlöslichkeit. Dies ist zunächst etwas verwunderlich, da die Halogenalkane ja keine Wasserstoffbrücken-Bindungen mit Wasser-Molekülen eingehen können. Allerdings sind Halogenalkan-Moleküle permanente Dipole, genau wie Wasser-Moleküle. Daher können sich Keesom-Kräfte (siehe oben) zwischen den Molekülen des Halogenalkans und den Wasser-Molekülen ausbilden.
Wie man beim Vergleich mit den entsprechenden Alkoholen sieht, sind diese Keesom-Kräfte aber sehr schwach im Gegensatz zu den Wasserstoffbrücken-Bindungen, die sich zwischen den OH-Gruppen der Alkohole und den Wasser-Molekülen bilden können.
Vorkommen in der Natur
In der Natur kommen Halogenalkane nur sehr selten vor. In der Doktorarbeit von Andreas Hornung kann man allerdings lesen, dass es in der Natur über 4.000 halogenierte Naturstoffe gibt, und zwar 2.200 chlorierte Verbindungen, 1.950 bromierte, 95 iodierte und 100 fluorierte Stoffe. Ein der bekanntesten Brom-Verbindungen der Natur ist der Farbstoff Purpur, der allerdings kein Bromalkan ist, sondern eine komplexere Verbindung. Überhaupt sind die meisten Halogenverbindungen, die Andreas Hornung in seiner Dissertation auflistet, keine Halogenalkane, sondern komplexere organische Verbindungen mit aromatischen Bestandteilen und weiteren Fremd-Atomen wie Sauerstoff und Stickstoff.
Verwendung
Der folgende Text stammt aus dem Wikipedia-Artikel "Halogenkohlenwasserstoffe" und unterliegt damit den gleichen Lizenzbedingungen wie alle Wikipedia-Artikel.
"Von Methan und Ethan leiten sich eine Reihe von Halogenalkanen ab, die in Technik und Alltag vielfältig Verwendung finden. Chloralkane sind gebräuchliche Lösungsmittel für Fette und Harze: Dichlormethan und Trichlormethan (Chloroform) werden beispielsweise zum Extrahieren pflanzlicher Öle und zum Entfetten von Metallteilen verwendet. Trichlorethen wurde bei der „chemischen Reinigung“ als Kleiderbad eingesetzt.
Die mengenmäßig wichtigsten Halogenkohlenwasserstoffe sind die Chlorkohlenwasserstoffe (CKW), Fluorkohlenwasserstoffe (FKW) und die Fluorchlorkohlenwasserstoffe (FCKW). Zunehmend werden Bromkohlenwasserstoffe als Flammschutzmittel verwendet.
Viele Halogenkohlenwasserstoffe wirken als ozonabbauende Verbindungen und/oder als Treibhausgase. Die Verwendungsbereiche für Halogenkohlenwasserstoffe [...] sind heute weitgehend verboten [...]."
Zusammenfassung
Die physikalischen Eigenschaften der Halogenalkane werden weitgehend durch die polare C-X-Bindung und die durch den Dipolcharakter der Moleküle bedingten Keesom-Kräfte bestimmt, aber auch London-Kräfte haben einen erheblichen Einfluss auf die physikalischen Eigenschaften.
Halogenalkane haben höhere Dichten, höhere Siedepunkte und höhere Schmelzpunkte als Alkane mit gleicher Kettenlänge, aber auch eine bessere Wasserlöslichkeit.
Je größer die Kettenlänge eines Halogenalkans, desto mehr ähneln die physikalischen Eigenschaften denen des entsprechenden Alkans, weil der Einfluss der C-X-Bindung immer geringer wird, je länger die C-Kette ist.
Halogenalkane werden meistens künstlich hergestellt, in der Natur kommen zwar viele halogenierte organische Verbindungen vor, die aber meistens komplexer sind als einfache Halogenalkane.
Halogenalkane sind wichtige Zwischenprodukte der chemischen Industrie und finden vielseitige Verwendung in der Technik und im Alltag, zum Beispiel als Lösemittel, Feuerlöschmittel etc. Viele Halogenalkane sind aber auch Treibhausgase und daher sehr schädlich für die Umwelt.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Webseite zum Lösungsbuch zu "Get Ready for Organic Chemistry" von Leroy G. Wade, ISBN 032183296
- Wikipedia, verschiedene Artikel zu Halogenalkanen
- Andreas Hornung, "Halogenasen aus Actinomyceten: Funktionelle und phylogenetische Studien". Dissertation 2005.
Seitenanfang -
weiter mit den Grundlagen der Nucleophilen Substitution...