Die dreiprotonige Phosphorsäure H3PO4 hat drei pKS-Werte, einen für jede Protolysestufe. Zunächst interessiert uns nur die erste Protolysestufe, bei der aus dem Phosphorsäure-Molekül das Dihydrogenphosphat-Anion H2PO4- wird. Der pKS-Wert der ersten Protolysestufe beträgt 2,13.
Wir wollen nun den pH-Wert einer 1-molaren Phosphorsäure berechnen. Dazu wenden wir zunächst wieder die allgmeine Gleichung für schwache Säuren an, obwohl Phosphorsäure schon eine recht "starke" mittelstarke Säure ist. Wenn wir die angegebenen Werte einsetzen, erhalten wir:
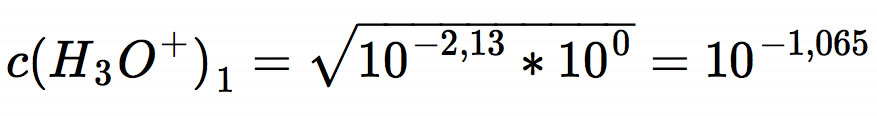
Der pH-Wert der Lösung müsste also bei ca. 1,1 liegen.
Nun ist die Phosphorsäure H3PO4 aber eine dreiprotonige Säure, also kann sie ein weiteres Proton abgeben, das dann den pH-Wert weiter erniedrigt. Und auch ein drittes Proton kann noch abgegeben werden, dadurch sollte der pH-Wert noch weiter sinken.
Aber jetzt mal unter uns: Wie wahrscheinlich ist es eigentlich, dass ein bereits negativ geladenes Ion (nämlich das Dihydrogenphosphat-Ion H2PO4-) noch ein Proton abgibt, das ja positiv geladen und somit vom Anion "festgehalten" wird?
Sehr unwahrscheinlich! Entsprechend groß ist der pKS-Wert dieser Protolyse, nämlich 7,2. Das heißt mit anderen Worten, es gibt kaum Dihydrogenphosphat-Anionen, die ein weiteres Proton abgeben. Jedenfalls nicht, wenn keine äußere Einflüsse dazu führen, dass das Protolysegleichgewicht nach rechts verschoben wird. Die Anwesenheit einer starken Base wäre zum Beispiel ein solcher äußerer Einfluss. Aber wir reden hier ja über wässrige Lösungen der Säure und nicht über Neutralisationen oder ähnliche Reaktionen.
Die wenigen Protonen, die abgegeben werden, verändern die bereits vorhandene Oxoniumionen-Konzentration nur unwesentlich, so dass der pH-Wert von 1,1 nicht noch weiter unterschritten wird.
Für den pH-Wert einer mehrprotonigen Säure ist in der Regel nur der erste Protolyseschritt maßgebend. Ist der pKS-Wert der zweiten Protolyse deutlich größer als der pKS-Wert der ersten Protolyse, so kann man die zweite (und erst recht die dritte) Protolyse vernachlässigen.
Für Experten
Im letzten Chemie-GK bin ich von meinen Schülern immer wieder gefragt worden, ob die zweite Protolysestufe nicht doch einen Einfluss auf den pH-Wert einer sauren Lösung hat. Um diesen interessierten Schülern zu beweisen, dass das nicht der Fall ist, habe ich tatsächlich mal eine Berechnung durchgeführt, und zwar am Beispiel der Zitronensäure. Wegen der recht komplizierten Formeln kann ich den Rechenweg nur als PDF-Dokument zur Verfügung stellen, das Sie sich hier herunter laden können.