Ein schöner Versuch
Zur "Auflockerung" des Unterrichts und vor allem zur weiteren Erkenntnisgewinnung führt man oft den folgenden Versuch vor:
Versuch 3
Reaktion von Chlorwasserstoff mit Ammoniak
Durchführung:
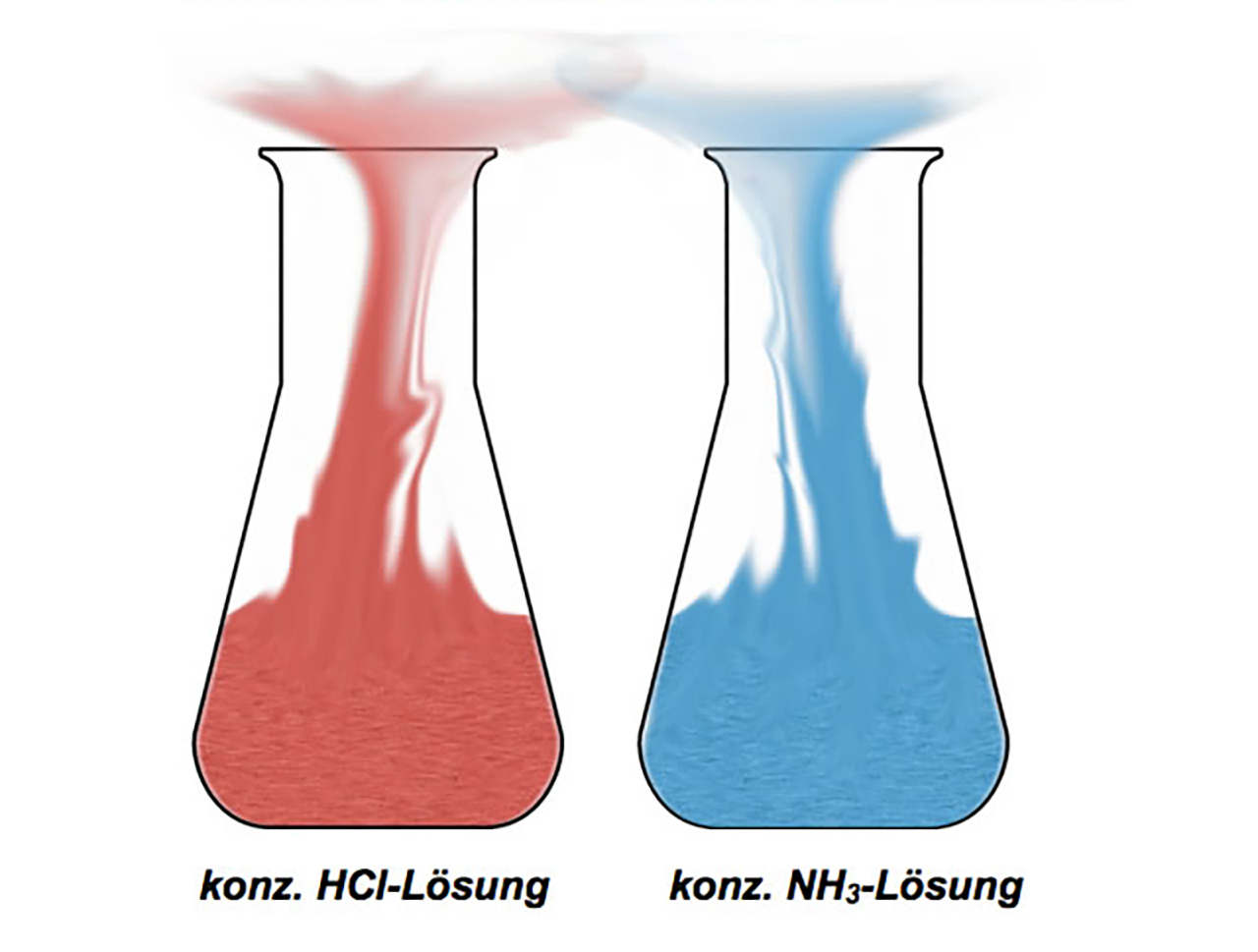
Ein Weithals-Erlenmeyerkolben wird mit etwas konz. Salzsäure befüllt, ein anderer Weithals-Erlenmeyerkolben mit der gleichen Menge konz. Ammoniaklösung. Dann werden beide Erlenmeyerkolben dicht nebeneinander gestellt, am besten vor einem dunklen Hintergrund.
Beobachtungen:
Bei diesem Versuch bildet sich schöner dichter weißer Nebel an den Mündungen der beiden Erlenmeyerkolben.
Deutung
Schauen wir uns die Reaktionsgleichung an:
$HCl_{(g)} + NH_{3_{(g)}} \to NH_{4}Cl_{(s)}$
HCl ist hier der Protonendonator und NH3 der Protonenakzeptor. Wasser ist an dieser Protolyse nicht beteiligt. Zunächst bilden sich bei dieser Protolyse Ammonium- und Chlorid-Ionen, die sich aber noch in der Gasphase sehr schnell gegenseitig anziehen und dann zum weißen Feststoff Ammoniumchlorid NH4Cl werden.
Warum ist dieser Versuch bzw. diese Protolyse so interessant?
Eigentlich sollte dieser Versuch nur zeigen, dass es auch Protolysen gibt, bei denen Wasser keine Rolle spielt. Eine Protolyse ist lediglich die Übertragung eines Protons von einem Donator auf einen Akzeptor. Von "Wasser" ist in dieser Definition nicht die Rede. Dennoch ist Wasser wichtig für die meisten Säure-Base-Reaktionen, die im Chemie-Unterricht behandelt werden. Die "üblichen Reaktionen" zwischen Säuren und Basen laufen nämlich in wässriger Lösung ab, der Versuch mit Ammoiak und Chlorwasserstoff ist eine der wenigen Ausnahmen.