Die metallische Bindung ist recht schnell erklärt. Betrachten wir einmal einen winzigen Ausschnitt aus einem Stückchen Natrium:
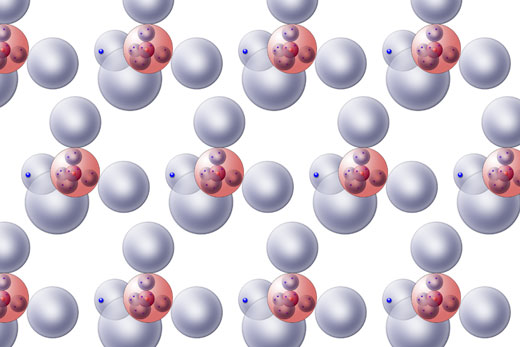
Einige Atome des festen Natriums
Autor: Ulrich Helmich, Lizenz: Public domain.
Wir sehen hier viele Natrium-Atome mit ihren Kugelwolken. In der äußeren Schale des Na-Atoms hält sich genau ein Elektron auf. Aber so, wie auf dem Bild zu sehen, ist metallisches Natrium in Wirklichkeit gar nicht aufgebaut. Welche Bindungskraft soll hier die Atome zusammenhalten?
Das Elektronengas-Modell
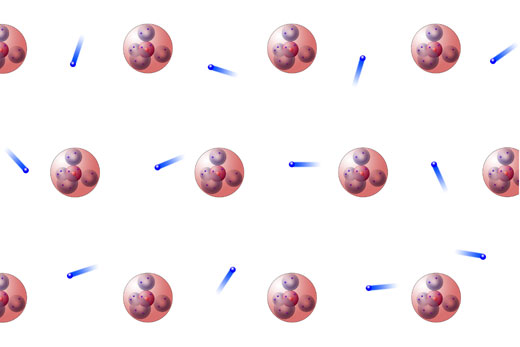
Elektronengas und Atomrümpfe in festem Natrium
Autor: Ulrich Helmich, Lizenz: Public domain.
Die Natrium-Atome haben ihre Außenelektronen abgegeben, allerdings nicht wie bei der Ionenbindung an einen Elektronanakzeptor (beispielsweise Chlor), sondern die Elektronen verbleiben im Metall und bilden ein so genanntes Elektronengas. Wenn keine elektrische Spannung an das Natrium-Metall angelegt wird, bewegen sich die Elektronen mit hoher Geschwindigkeit in allen möglichen Richtungen durch das Metall.
Das Elektronengas hält die positiv geladenen (und daher rot gezeichneten) Atomrümpfe Na+ zusammen, was ich mit der nächsten Abbildung noch stärker verdeutlichen möchte.
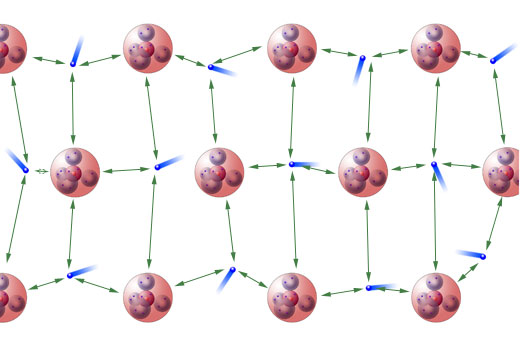
Das Elektronengas hält die Atomrümpfe zusammen
Autor: Ulrich Helmich, Lizenz: Public domain.
Ich habe hier einfach mal die Anziehungskräfte zwischen den Elektronen und den Atomrümpfen in Grün eingezeichnet. Selbstverständlich müsste man auch die Abstoßungskräfte zwischen den Elektronen und vor allem die Abstoßungskräfte zwischen den Atomrümpfen berücksichtigen. Aber hier kann man nun einmal auf gänzlich unwissenschaftliche, aber logische Weise schlussfolgern: Wenn die Anziehungskräfte insgesamt nicht stärker wären als die Abstoßungskräfte, würde das Metall gar nicht existieren, weil die Atomrümpfe dann nämlich auseinander fliegen würden.
Eigenschaften der Metalle
Die Eigenschaften der Metalle werden durch dieses Elektronengas-Modell recht gut erklärt, vor allem die elektrische Leitfähigkeit. Die Elektronen sind frei im Metall beweglich. Legt man eine elektrische Spannung von zum Beispiel 6 Volt Gleichstrom an, so fangen die Elektronen an, sich in eine bestimmte Richtung zu bewegen, nämlich in Richtung auf den Pluspol.
Die gute Verformbarkeit der Metalle ist ebenfalls eine Folge der metallischen Bindung. Die Elektronen sind frei beweglich, gleiches gilt für die Atomrümpfe, die sich ja gegenseitig sogar abstoßen und nur von den beweglichen Elektronen zusammengehalten werden. Ein Ionenkristall dagegen ist nicht verformbar, weil eine kleinste Verschiebung eines Teils der Ionen zu einer Zone der Abstoßung innerhalb des Kristalls führt, wie folgendes Bild gut zeigt:
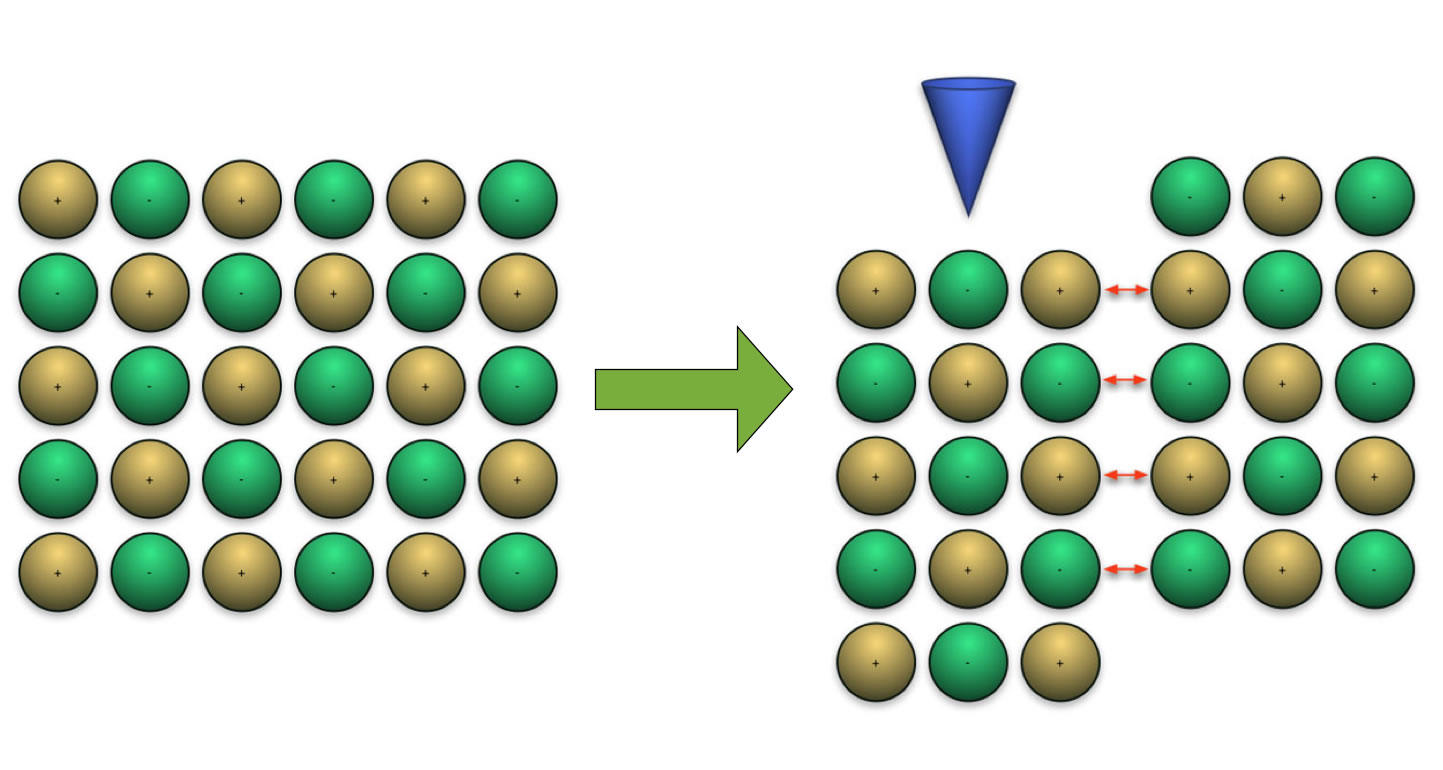
Ein Verbiegen des Kristalls führt zum Bruch
Wenn man versucht, einen Ionenkristall zu verbiegen (blauer Pfeil), so verschiebt sich ein Teil des Kristalls derart, dass gleich geladene Ionen einander gegenüberliegen. Diese stoßen sich gegenseitig ab, und es ensteht ein Bruch oder Riss im Kristall.
Bei einem Metall ist das anders:
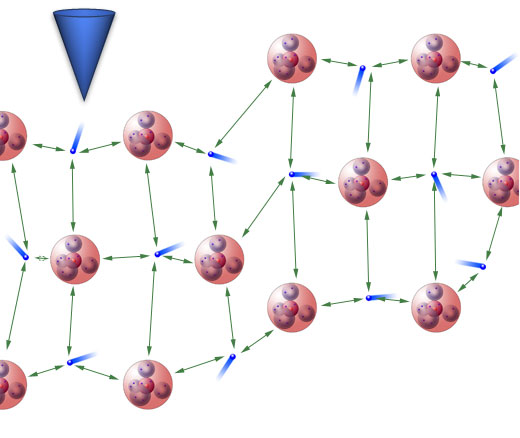
Ein Verbiegen des Metalls ist kein Problem
Es treten keine zusätzlichen Abstoßungskräfte auf, und die Anziehungskräfte wirken immer noch, auch wenn bereits ein kleiner Bereich des Metalls verbogen bzw. verschoben ist.
Seitenanfang -
Weiter mit dem Begriff der Elektronegativität ...