Elektronentransport über Redoxsysteme
Was nun kommt, wird in drei verschiedenen Büchern auf mindestens vier unterschiedliche Weisen beschrieben, daher werde ich mich hier sehr kurz fassen und sehr allgemein ausdrücken. Extrem hilfreich wäre es, wenn Sie kurz mal meine Chemie-Seiten zum Thema "Spannungsreihe der Metalle" durchlesen würden. Eines der Bilder von dieser Seite zeige ich Ihnen mal und bespreche es auch kurz:
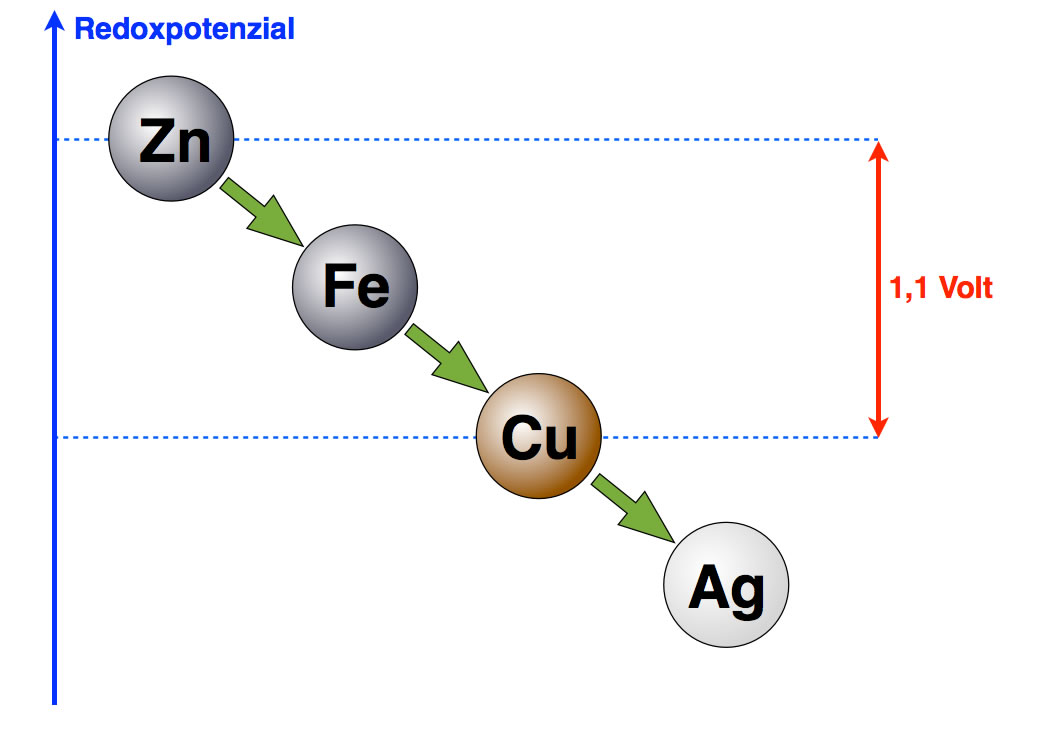
Hier sehen wir vier Metalle, nämlich Zink, Eisen, Kupfer und Silber. Bei solchen Graphiken zeichnet man die Stoffe mit dem negativsten Redoxpotenzial immer oben ein, und die Stoffe mit dem positivsten Redoxpotenzial unten. Das Zink hat also das negativste Redoxpotenzial und Silber das positivste. Wenn also jemand sagt, das Zink habe das "höchste" Redoxpotenzial und das Silber das "niedrigste", so meint er zwar das Richtige, aber ganz korrekt ist die Ausdrucksweise nicht.
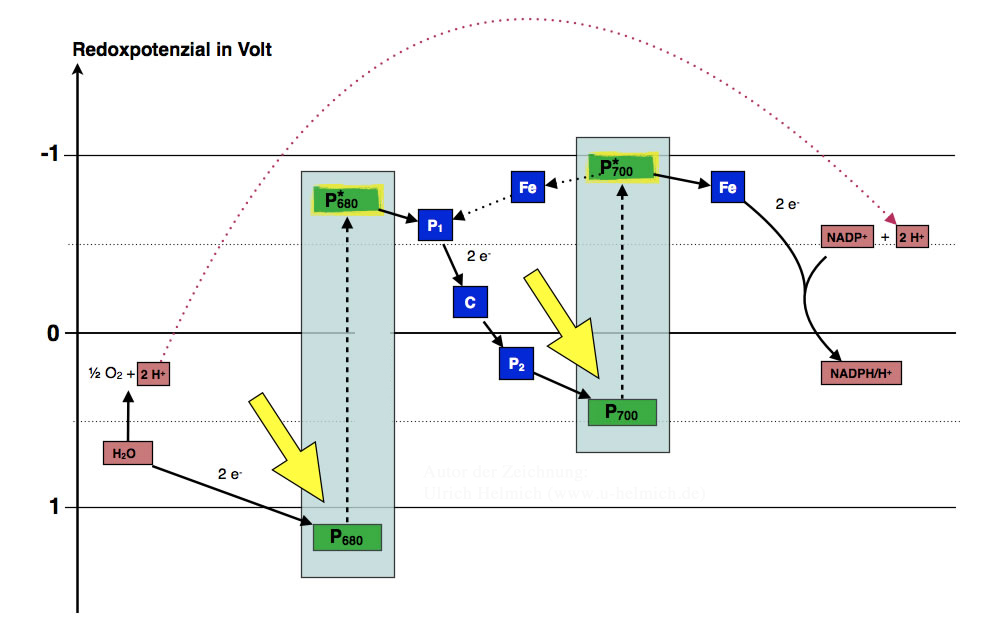
Das Reaktionszentrum P680 hat ein recht positives Redoxpotenzial, nämlich im Bereich +0,85 Volt. Streng genommen ist es damit sogar "edler" als das Silber. Wenn dieses Molekül nun Elektronen vom Wasser aufnimmt und zudem durch Lichtabsorption angeregt wird, ist es in der Lage, die Elektronen sehr leicht wieder abzugeben. Chemisch gesprochen, wird dadurch sein Redoxpotenzial negativer, es "steigt" von +0,85 Volt auf ca. 0 Volt. Die beiden Elektronen können jetzt leicht abgespalten werden. Warum das Redoxpotenzial mit der Absorption von Licht ansteigt, habe ich auf der letzten Seite erklärt.
Ein Elektronen-Donator wie das angeregte P680 kann seine Elektronen nur dann abgeben, wenn ein Elektronen-Akzeptor vorhanden ist, also ein Molekül oder ein Atom oder ein Ion, das in der Lage ist, die abgegebenen Elektronen auch wieder aufzunehmen. Mit anderen Worten, ein Molekül oder Atom mit einem positiveren Redoxpotenzial als der Elektronen-Donator, in diesem Fall also das angeregte P680.
Das Plastochinon (hier als P1 abgekürzt) ist ein geeigneter Elektronen-Akzeptor.
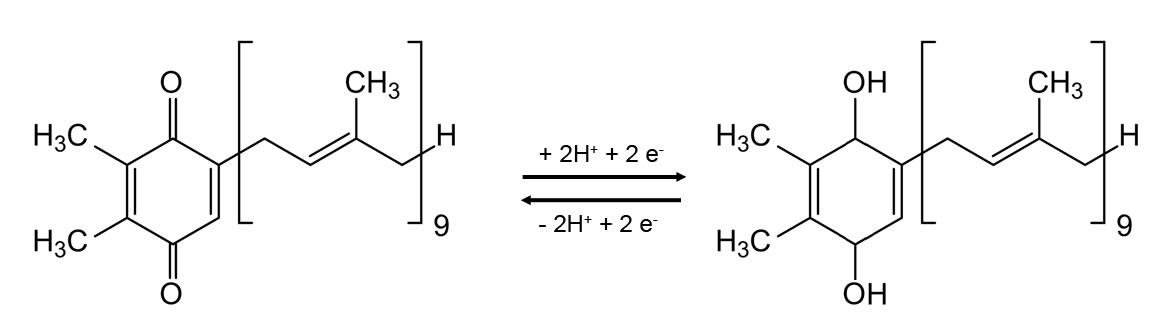
Wie man auf diesem Bild sieht, kann das Plastochinon (oxidierte Form links) nicht nur zwei Elektronen aufnehmen, sondern auch noch zwei Protonen. Die beiden Keto-Gruppen im Molekül links werden dann zu Hydroxy-Gruppen reduziert. Diese Reaktion ist voll reversibel. Daher ist Plastochinon ein guter Wasserstoff-Transporter, ähnlich wie das NADP+, das wir bereits kennengelernt haben. Die für die Reduktion notwendigen Protonen bezieht das Plastochinon aus dem umgebenden Medium. Es sind ja genug Protonen vorhanden, bei der Photolyse des Wassers beispielsweise wurden zwei Protonen pro Wasser-Molekül freigesetzt.
Vom Plastochinon geht es weiter zum Cytochrom. Dabei findet die Rückreaktion des Plastochinons zur oxidierten Keto-Form statt; die beiden Protonen und die beiden Elektronen werden wieder freigesetzt, und das Cytochrom übernimmt die beiden Elektronen.
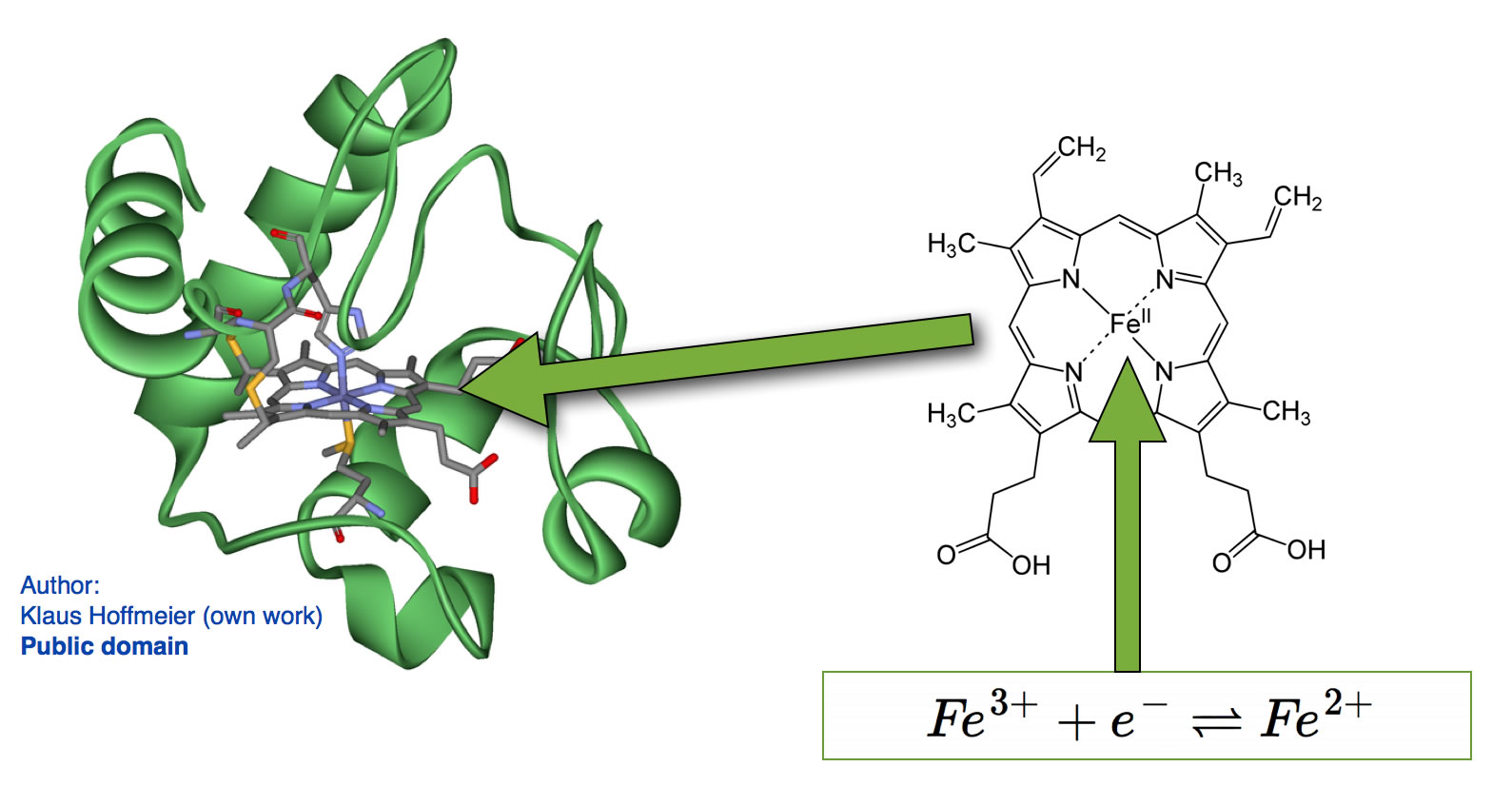
Links sehen Sie das Protein Cytochrom (Zeichnung von Klaus Hoffmeier, public domain). Das kleine Protein enthält in der Mitte eine Häm-Struktur, ähnlich wie im Hämoglobin. Rechts ist eine solche Häm-Struktur vergrößert dargestellt. In der Mitte der Häm-Struktur befindet sich ein Eisen-Ion. Eisen-Ionen können zweiwertig als Fe2+ oder dreiwertig als Fe3+ vorkommen. Das dreiwertige Eisen ist die oxidierte Form, das zweiwertige Eisen die reduzierte Form.
Wenn das Cytochrom ein Elektron vom Plastochinon aufnimmt, so wird dreiwertiges Eisen zu zweiwertigem Eisen reduziert. Ein Plastochinon-Molekül kann also zwei Cytochrom-Moleküle reduzieren.
Das reduzierte Cytochrom kann sein Elektron wieder abgeben, dann entsteht das oxidierte Cytochrom mit dem dreiwertigen Eisen in der Mitte. Damit das Cytochrom sein Elektron abgeben kann, muss wieder ein geeigneter Elektronen-Akzeptor vorhanden sein, der ein positiveres Redoxpotenzial hat als das Cytochrom.
Plastocyanin ist ein solcher Elektronen-Akzeptor. Während Cytochrom ein Eisen-Ion in der Mitte besitzt, enthält Plastocyanin ein Kupfer-Ion, das ebenfalls seine Oxidationsstufe ändern kann, von einwertig Cu+ nach zweiwertig Cu2+. Im Grunde läuft hier alles genau so ab wie beim Cytochrom. Durch Aufnahme eines Elektrons wird das zweiwertige Kupfer zu einwertigem Kupfer reduziert. Nach Abgabe des Elektrons an das P700-Chlorophyll des nächsten Photosystems liegt wieder zweiwertiges Kupfer vor.
Kommen wir nun zu einer sehr wichtigen Frage, die hier allerdings noch nicht beantwortet wird:
Wieso müssen die Elektronen vom angeregten P680 über drei (oder mehr) zwischengelagerte Redoxsysteme auf das P700 übertragen werden?
Für die Dunkelreaktion wird nicht nur Wasserstoff benötigt, um das Kohlendioxid zu reduzieren, sondern auch Energie. Energie wird in der Zelle meistens in Form von ATP geliefert. Das ATP muss aber irgendwo hergestellt werden. Bei der Photosynthese ist die Lichtreaktion auch für diese ATP-Herstellung verantwortlich. Und das ATP wird hergestellt, während die Elektronen von einem Redoxsystem zum nächsten Redoxsystem "herunterpurzeln". Dieser Vorgang ist aber recht komplex und soll auf einer eigenen Seite näher erläutert werden.