Myosine (von griechisch myos = Muskel) sind Motorproteine in eukaryotischen Zellen. Sie kommen zum Einsatz bei der Bewegung von Vesikeln in der Zelle (zum Beispiel wenn Golgi-Vesikel zur Zellmembran transportiert werden), bei der Plasmaströmung, bei der Fortbewegung und Formveränderung von Zellen und bei der Kontraktion von Muskelfasern.
"Motorprotein" heißt, dass sich Myosin-Moleküle in der Zelle aktiv unter Verbrauch von ATP bewegen können. Allerdings können sie das nicht alleine, sondern sie brauchen eine Art "Schienen", auf denen sie entlang gleiten können. Diese "Schienen" sind die Actinfilamente der Zelle.
Entdeckt wurden die Myosine in Muskelzellen, später fand man dann auch heraus, dass Myosine zusammen mit Actinfilamenten für den intrazellulären Transport von Vesikeln zuständig sind. Insgesamt hat man heute 14 Klassen von Myosinen entdeckt, allein in den Zellen der Säugetiere kommen 11 verschiedene Myosin-Arten vor [1].
Struktur
Die Muskel-Myosine sind extrem lange und schwere Proteine, die Molekülmasse beträgt ca. 540 kD, die Moleküle sind um die 145 nm lang und bestehen aus etwa 2000 Aminosäuren [3]. Diese Werte werden nur noch vom Titin übertroffen, das ebenfalls ein Muskelprotein ist [1].
Das Myosin II, also das Muskel-Myosin, besteht aus insgesamt sechs Proteinketten, zwei schweren Ketten und vier leichten Ketten [2].
Die schweren Ketten
Die beiden schweren Ketten des Muskelfaser-Myosins bestehen aus jeweils drei Abschnitten:
- Kopf-Region
- Hals-Region
- Schwanz-Region
Insgesamt bestehen die schweren Ketten aus ca. 2000 Aminosäuren [6] und haben eine molare Masse von ca. 220 kDa [4]. Mutationen der schweren Ketten können zahlreiche angeborene Erkrankungen zur Folge haben, vor allem Skelettmuskelmyopathien und Kardiomyopathien [4].
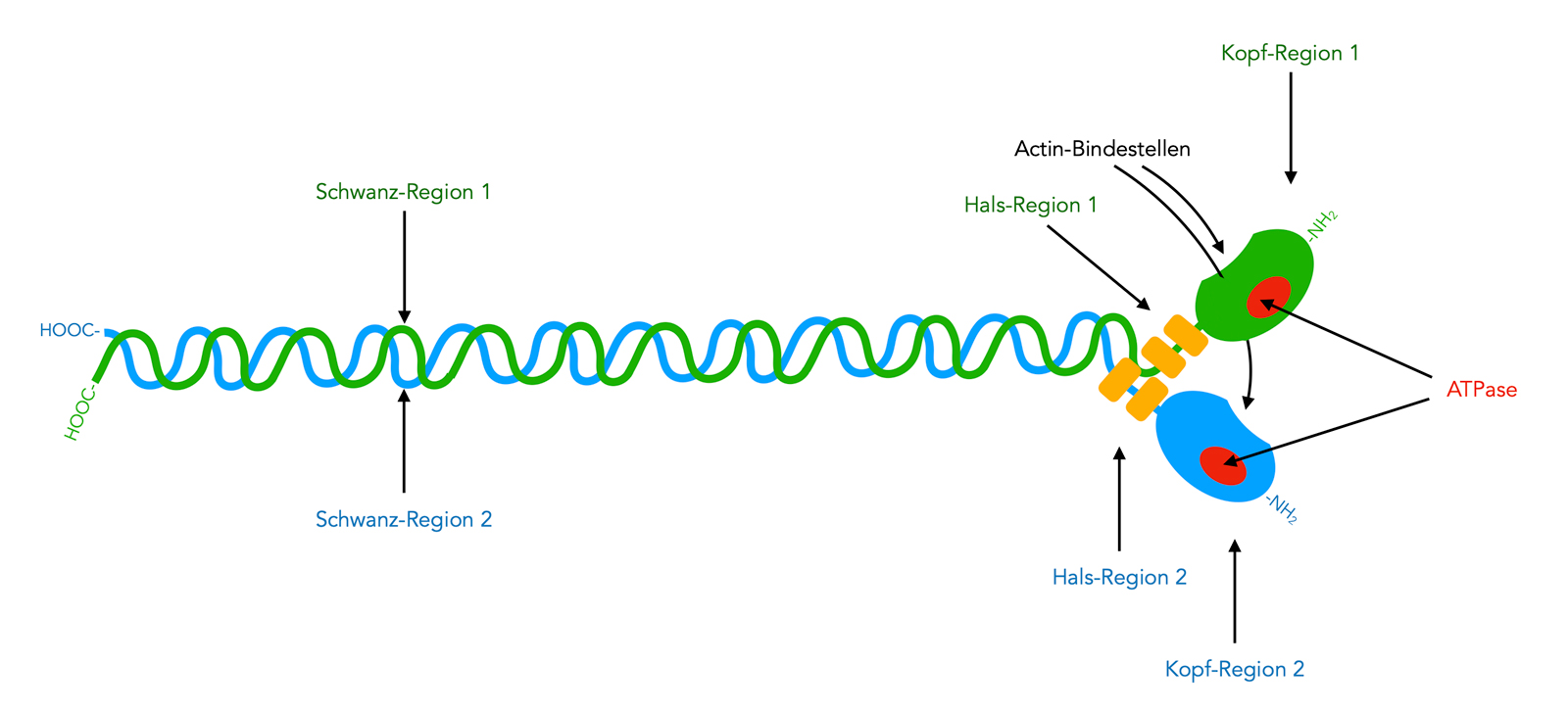
Ein Myosin-Molekül
Autor: Ulrich Helmich 03/2023, Lizenz: Public domain
Auf dieser Zeichnung sehen wir ein Myosin-Molekül schematisch dargestellt. Die Bezeichnung "Molekül" ist allerdings nicht ganz korrekt, denn an sich setzt sich das Myosin aus sechs Molekülen zusammen: zwei schweren Ketten (grün und blau gezeichnet) und vier leichten Ketten (gelb dargestellt).
Kopf-Region
Diese Region wird auch als Motordomäne bezeichnet, weil hier die ATPase-Aktivität lokalisiert ist. Die Kopfregion kann also ATP-Moleküle zerlegen und dessen chemische Energie in mechanische Energie umwandeln. Die Kopf-Region besteht aus zwei kugelförmigen Teilen mit einem Durchmesser von je 11 nm.
Außerdem enthält die Kopf-Region eine Bindestelle zu Actinfilamenten, was für die Kontraktion der Muskelzelle von Bedeutung ist.
Hals-Region
Die kurze Halsregion ist das gelenkige Verbindungsstück zwischen der Kopf-Region und der Schwanz-Region. Auch diese Region ist recht variabel, was die verschiedenen Myosin-Typen angeht [4]. Mit der Hals-Region verbunden sind noch zwei kleinere Proteine, die Myosin-Leichtketten [2].
Schwanz-Region
Diese Region, die auch als Schaft-Region bezeichnet wird, macht die Hauptmasse der schweren Ketten aus. Sie ist ca. 134 nm lang und 2 nm dick. Die Struktur der Schwanz-Region unterscheidet sich stark bei den verschiedenen Myosin-Typen, sie ist sehr variabel [4].
Die Schwanz-Regionen der beiden schweren Ketten haben eine helixartige Konformation. Die beiden Schwanz-Regionen eines Myosin-Moleküls verbinden sich dann zu einer Doppelhelix, wie man auf dem Bild auch gut erkennen kann.
Die leichten Ketten
Die leichten Ketten befinden sich an den Hals-Regionen der schweren Kette, jede Hals-Region ist mit zwei leichten Ketten locker verbunden. Die molare Masse der leichten Ketten liegt bei 19 bzw. 22 kDa.
Die leichten Ketten (Myosin light chains) gehören zu den Ca2+-bindenden Proteinen. Das Binden der Calcium-Ionen ist unerlässlich für die ATPase-Aktivität der Kopfdomänen [5].
Experimente mit Myosinen
Durch geschickte Experimente konnte man die Kopfdomänen von dem restlichen Myosindomänen abtrennen und untersuchen.
Man konnte nachweisen, dass die Kopfdomänen ATP aufnehmen und spalten können. Nach der Aufnahme von ATP können sich die Kopfdomänen an G-Actin und auch an F-Actin (Actinfilamente) anlagern, ihre Konformation ändern (quasi mit dem Kopf nicken) und wieder vom Actin lösen.
Löst man mehrere Myosin-Moleküle in physiologischen Salzlösungen, lagern sie sich zu dickeren Bündeln zusammen, die als Myosinfilamente bezeichnet werden [1].
Myosinfilamente
In den Muskeln der Wirbeltiere bilden viele Myosin-Moleküle zusammengesetzte Myosinfilamente.
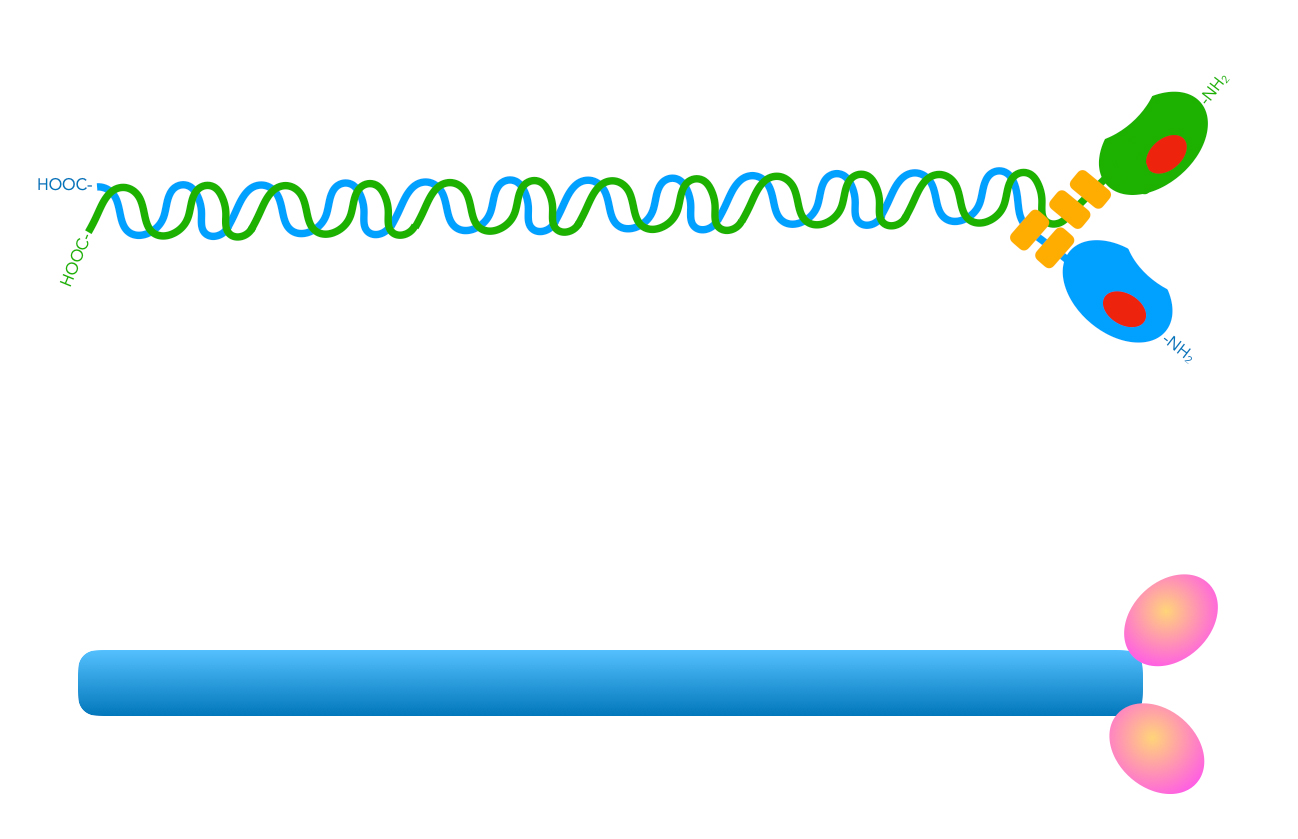
Vereinfachte Darstellung eines Myosin-Moleküls
Autor: Ulrich Helmich 03/2023, Lizenz: Public domain
Auf diesem Bild sehen wir zunächst eine stark vereinfachte Darstellung eines Myosin-Moleküls. Die Hals-Region mit den leichten Ketten wurden vernachlässigt, entscheidend sind die lange Schwanzregion mit den beiden Kopfregionen.
Mehrere solcher Moleküle bilden dann Myosinfilamente, die folgendermaßen aufgebaut sind:

Vereinfachte Darstellung eines Myosinfilaments
Autor: Ulrich Helmich 03/2023, Lizenz: Public domain
An einer sogenannten Z-Scheibe (schwarz) sind auf beiden Seiten zusammengesetzte Myosinfilamente befestigt. Die vielen Kopfregionen ragen aus den Filamenten heraus. Sie spielen dann eine wichtige Rolle bei der Kontraktion der Muskelfaser.
Quellen:
- Lexikon der Biologie, Spektrum-Verlag, Artikel "Myosin"
- Wikipedia, Artikel "Myosin".
- Lexikon der Biochemie, Spektrum-Verlag, Artikel "Myosin"
- Lackner, Peetz: Myosin-Schwerketten. In: Lexikon der Medizinischen Laboratoriumsdiagnostik. Springer-Verlag 2019.
- engl. Wikipedia, Artikel "Myosin light chain".
- engl. Wikipedia, Artikel "Myosin"