Actin-Filamente sind neben Mikrotubuli und Intermediär-Filamenten ein wichtiger Bestandteil des Cytoskeletts eukaryotischer Zellen.
Das Cytoskelett wird auf dieser Lexikonseite ausführlich beschrieben.
Actin-Filamente (F-Actin) sind aus dem globulären Protein Actin (G-Actin) aufgebaut. Dieses Protein wird auf dieser Seite des Biologie-Lexikons ausführlicher beschrieben.
Filamentbildung
Das folgende Bild zeigt die Bildung von Actin-Filamenten (F-Actin) durch die Polymerisation vieler G-Actin-Monomere. Diese Polymerisation ist ein Beispiel für Selbstaggregation (self-assembly), die also ohne Zutun von Enzymen spontan auch im Reagenzglas abläuft, wenn die Actin-Konzentration einen bestimmten Wert überschreitet und genügend ATP zur Verfügung steht [8].
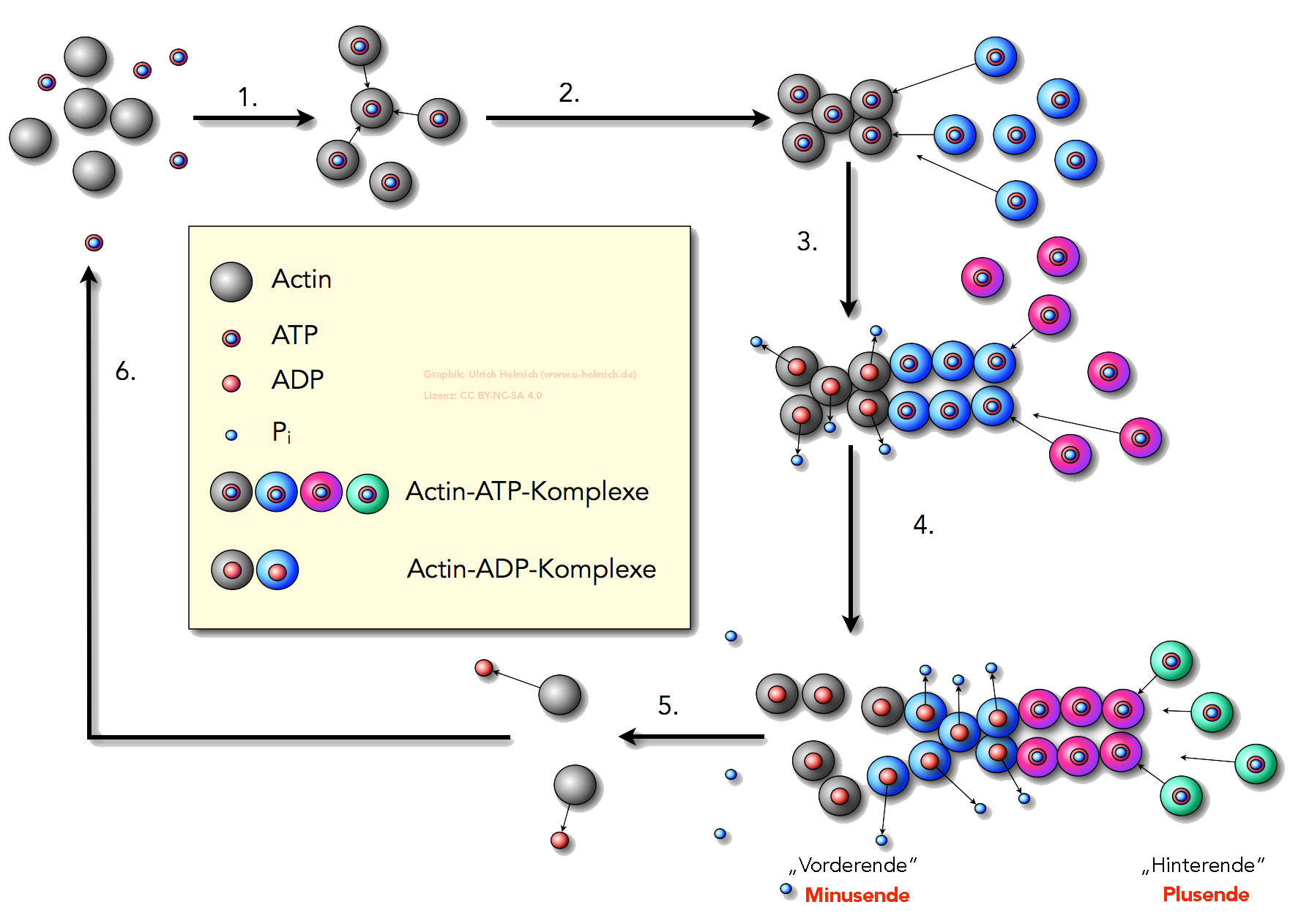
Bildung von F-Actin durch Polymerisation von G-Actin-ATP
Autor: Ulrich Helmich 2023, Lizenz: CC BY-NC-SA 4.0
Die Abbildung 1 (Vergrößern durch Anklicken) zeigt die Bildung eines Actin-Filamentes (F-Actin) aus Actin-Monomeren (G-Actin). Zur Verdeutlichung des Wachstumsprozesses wurden die Actin-Monomere in verschiedenen Farben dargestellt. Es handelt sich aber stets um die gleichen Monomere, nämlich G-Actin-ATP-Komplexe.
- Einige Actin-Monomere nehmen je ein ATP-Molekül auf und werden dadurch aktiviert. Es bilden sich Actin/ATP-Komplexe, hier grau dargestellt.
- Diese Actin/ATP-Komplexe sind sie in der Lage, eine Art "Kristallisationskeim" zu bilden, an den sich weitere G-Actin/ATP-Komplexe anlagern können (hier blau gezeichnet).
- Weitere Actin/ATP-Komplexe (diesmal rot gezeichnet) lagern sich an das "Hinterende" des kurzen Actin-Filamentes an. Die "älteren" (grau gezeichneten) Actin/ATP-Komplexe am "Vorderende" geben jetzt je eine Phosphatgruppe Pi ab, aus den Actin/ATP-Komplexen werden Actin/ADP-Komplexe.
In der Fachsprache bezeichnet man das "Hinterende" übrigens als Plusende, und das "Vorderende" als Minusende. Diese Begriffe werden wir hier jetzt übernehmen. - Noch mehr Actin/ATP-Komplexe (jetzt grün dargestellt) lagern sich an das Plusende an. Die "vorderen" Actin/ADP-Komplexe (grau) verlieren ihre Bindungsfähigkeit zum Filament und lösen sich von diesem.
- Die losgelösten Actin/ADP-Komplexe geben das ADP ab und werden wieder zu G-Actin-Monomeren.
- Diese können sich wieder mit ATP verbinden und stehen dann erneut für die Polymerisation zur Verfügung.
Die ATP-Bindung an die Actin-Monomere ist der erste Schritt der Polymerisation. Die Actin/ATP-Komplexe bilden dann kleinere Oligomere, von denen dann die eigentliche Polymerisation ausgeht. Bald nach dem Andocken eines Actin/ATP-Komplexes an das Plusende des Polymers wird Phosphat durch Hydrolyse abgespalten. Das Minusende des Actin-Filaments besteht dann nur aus Actin/ADP-Komplexen. Diese Actin/ADP-Komplexe haben eine geringere Bindungsstärke als die Actin/ATP-Komplexe. Das führt dazu, dass sich die "vorderen"Actin-Monomere wieder vom Filament ablösen.
Damit sich aus Actin-Monomeren (G-Actin) Actin-Filamente bilden (F-Actin), muss die Konzentration des freien Actins einen bestimmten kritischen Wert überschreiten. Diese kritische Wert ist bei den Actin-ADP-Komplexen 20 mal höher als bei den Actin-ATP-Komplexen. Mit anderen Worten: Actin-ATP-Komplexe vereinigen sich 20 mal leichter / schneller zu einem Actin-Filament als Actin-ADP-Komplexe [7].
Tretmühleneffekt: Daher wächst das Actin-Filament am Plusende, während es sich am Minusende wieder auflöst. In der Literatur ist dieses Phänomen als "Tretmühleneffekt" bekannt [6]. Ein Actin-Monomer "wandert" sozusagen durch das Filament von vorn nach hinten:
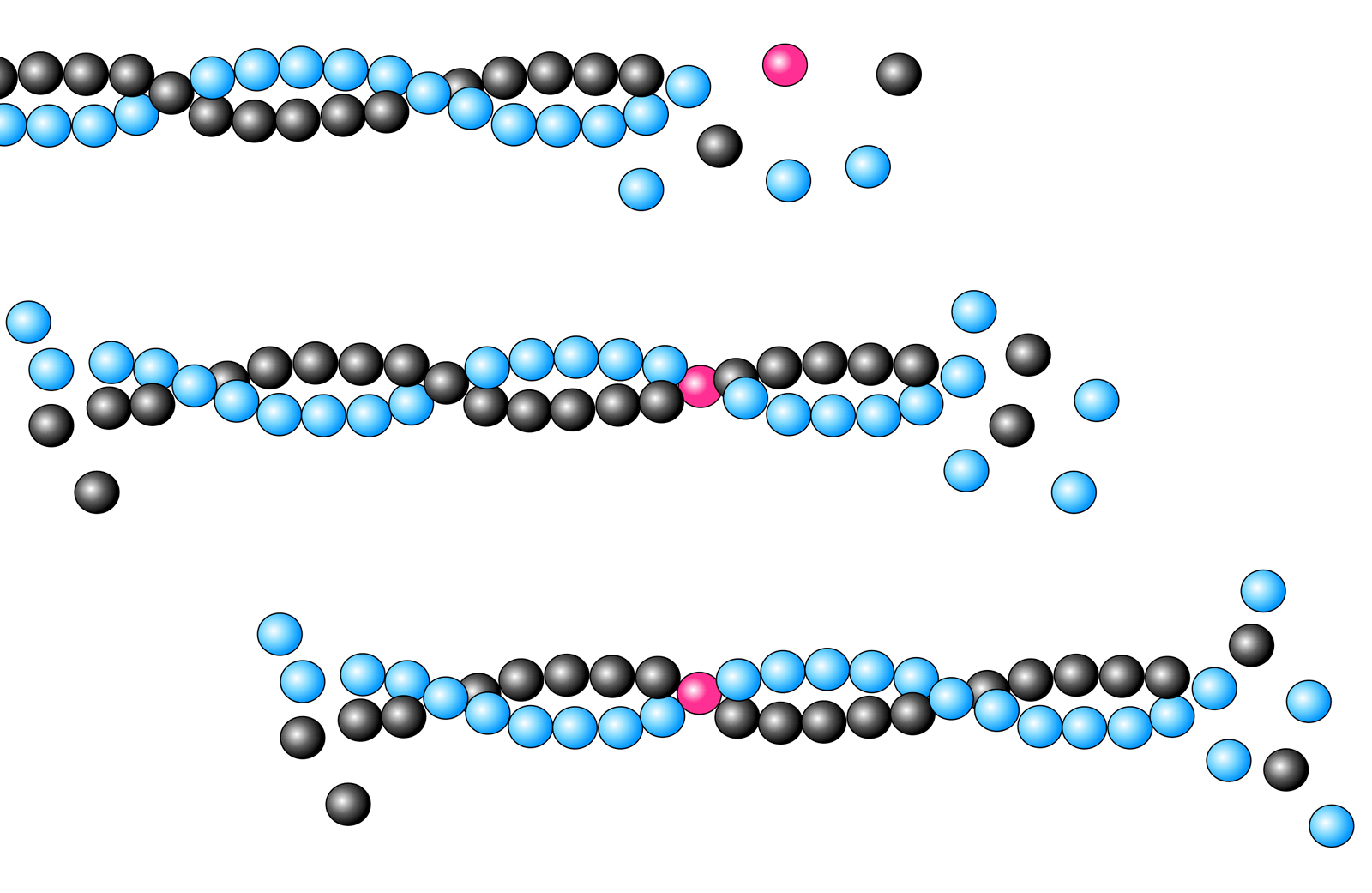
"Wanderung" eines Actin-Moleküls durch das Actin-Filament
Autor: Ulrich Helmich 2023, Lizenz: CC BY-NC-SA 4.0
Das rot markierte G-Actin-Molekül setzt sich zunächst an das Plus-Ende des Actin-Filaments. Im Laufe der nächsten Millisekunden lagern sich weitere G-Actin-Monomere an das Filament an, das markierte G-Actin-Molekül "wandert" dadurch in Richtung Minus-Ende. Auf dem dritten Bild ist es schon ziemlich weit in die Nähe des Minus-Endes gekommen.
Was man auf dem Bild schon ganz deutlich sieht: Die Actin-Monomere bilden nicht einfach einen langen Faden, sondern sie polymerisieren zu zwei langen Fäden, die sich helixartig umeinander winden. Die Dimensionen dieser Helix sind im nächsten Bild zu sehen.
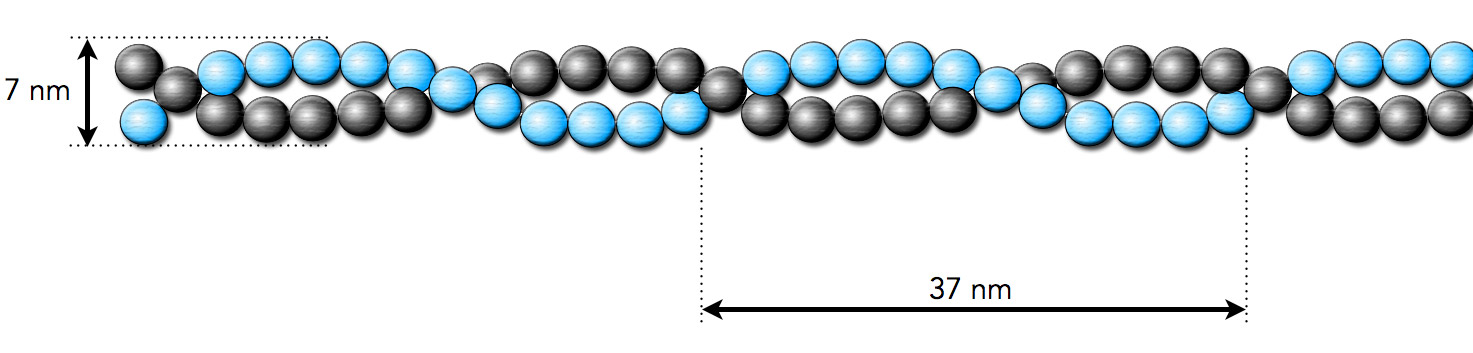
Ein Ausschnitt aus einem Actin-Filament
Autor: Ulrich Helmich, Lizenz: Public domain.
Nach Alberts et al. [6] hat ein Actin-Filament einen Durchmesser von ca. 7 nm. Wie das zu den 4 nm Durchmesser eines Monomers passt [8], fragt man sich da natürlich sofort; an sich käme man dann auf mindestens 8 nm Durchmesser. Alle 37 nm wiederholen sich die Windungen der Helix.
Übrigens bestehen zwischen den G-Actin-Monomeren in den Filamenten keine kovalenten Bindungen, die Monomere werden durch schwache chemische Bindungen locker zusammengehalten, und sie können daher auch recht schnell wieder auseinander fallen. Das ist auch für die korrekte Funktion in der Zelle notwendig. Das Actin-Filament kann an dem einen Ende schnell wachsen, während es an dem anderen Ende wieder aufgelöst wird. Auf diese Weise "wandert" das Filament durch das Zellplasma. Ohne solche sich quasi bewegenden Filamente wäre keine Plasmaströmung und keine Zellbewegung denkbar.
Actinfilamente in Muskelzellen
In den Muskelzellen der Tiere haben Actin-Filamente eine ganz besondere Bedeutung. Zusammen mit dem ebenfalls filamentförmigen Protein Myosin sorgen die Actin-Filamente für die Muskelkontraktion.
Demnächst wird ein Lexikonartikel "Muskelkontraktion" geschrieben, in dem weitere Einzelheiten dargestellt werden.
Actinfilamente in Pflanzenzellen
Während Actinfilamente in Tierzellen hauptsächlich für die Formgebung und die Beweglichkeit der Zelle zuständig sind, erfüllen sie in Pflanzenzellen andere bzw. zusätzliche Aufgaben. Die Form der Pflanzenzelle wird hauptsächlich durch die Zellwand vorgegeben, und die Beweglichkeit der ganzen Zelle spielt bei Pflanzenzellen so gut wie keine Rolle, durch die Zellwand ist die Pflanzenzelle relativ starr.
Typisch für Pflanzenzellen ist aber die Protoplasmaströmung; hier sind Actinfilamente zusammen mit Motorproteinen wie Myosin die Ursache. Bei der Zellteilung spielen Actinfilamente ebenfalls eine große Rolle, wenn sich die Zellplatte bildet.
Überall dort, wo sich die Zelle relativ schnell verändern muss, spielen Actinfilamente eine wichtige Rolle, zum Beispiel bei den Zellen in der Wurzelspitze, die extrem schnell wachsen, oder bei den Zellen der Pollenschläuche.
Die Chloroplasten in den Zellen der grünen Pflanzen dienen zur Absorption von Licht. Je nach Lichtintensität können sich diese Zellorganellen drehen. Bei hoher Lichtintensität wenden sie sich mit ihrer schmalen Seite dem einfallenden Licht zu, bei niedriger Lichtintensität drehen sie sich so, dass sie möglichst viel Licht mit ihrer breiten Seite aufnehmen können. Verantwortlich für diese Phototaxis sind Actin-Filamente in den Zellen des Blattes [8].
Beeinflussung der F-Actin-Polymerisation
Man hat inzwischen einige chemische Verbindungen entdeckt, welche die Polymerisation von G-Actin zu F-Action fördern oder hemmen. Hier sollen nur drei wichtige Beispiele erwähnt werden.
Profilin
Dieses Protein beschleunigt am Plus-Ende eines Actinfilaments den Einbau neuer G-Actin-Monomere. Das Protein kommt in allen eukaryotischen Zellen vor, nicht nur in Pflanzenzellen und ist sehr wichtig für die Funktion des Cytoskeletts.
"Dieses 16 kDa große Aktin-bindende Protein wurde 1976 als erstes Protein beschrieben, das nicht an Aktinfilamente, sondern an Aktinmonomere bindet. Zunächst glaubte man, die Funktion von Profilin bestehe darin, Aktinmonomere an bestimmten Stellen an der Polymerisation zu hindern, um sie auf ein Signal hin freizugeben und am Aufbau von Aktinfilamenten teilhaben zu lassen. Seit 1995 jedoch wurden mehrere Klassen von Proteinen bekannt ..., die Profilin-Aktin-Komplexe brauchen, um eine Polymerisation von Aktinfilamenten überhaupt zu ermöglichen, v. a. in Bereichen von hoher Bewegungsaktivität." [9]
Latrunculin B
Dieses Protein aus Seeschwämmen wie Negombata magnifica setzt sich an G-Actin-Monomere und blockiert diese, so dass sie keine Filamente mehr aufbauen können. Der Abbau der Filamente am Minus-Ende dagegen wird nicht behindert, so dass sich die Actinfilamente bei Zugabe dieses Wirkstoffes kontinuierlich verkürzen.
Gibt man Latrunculin B zu Pflanzenzellen, verlangsamt sich die Plasmaströmung, die Phototaxis der Chloroplasten wird beeinträchtigt, und auch das Wachstum der Zellen wird behindert [8].
Der Wirkmechanismus von Latrunculin B besteht darin, dass es die Bindung von ATP an G-Actin verhindert. Ohne gebundenes ATP kann G-Actin jedoch nicht zu F-Actin polymerisieren [10].
Bei den oben erwähnten Seeschwämmen hat das Protein die Aufgabe, Fressfeinde abzuwehren:
"Bei Berührung gibt der Schwamm eine rötliche Flüssigkeit frei, vor der Fische davon schwimmen. Können sie nicht entkommen, wie in einem Aquarium, wirkt das Sekret tödlich. Die vergifteten Fische zeigen innerhalb von Sekunden Symptome wie Hämorrhagie und einen Verlust des Gleichgewichts. Aus diesem Sekret konnten 1983 die Toxine Latrunculin A und B... isoliert werden." [10]
Phalloidin
Dieses Gift aus dem Grünen Knollenblätterpilz hemmt den Abbau von Actin an den Minus-Enden der Filamente, so dass diese nicht mehr abgebaut werden können. Die Dynamik des Cytoskeletts wird somit stark beeinträchtigt, Phalloidin gehört damit zu den sogenannten Cytoskelett-Inhibitoren. In der Molekularbiologie werden diese Giftstoffe verwendet, um das Cytoskelett der zu untersuchenden Zellen zu stabilisieren, so dass man es besser sichtbar machen kann [11].
Phalloidin gehört zu den Phallotoxinen, die sich durch einen interessanten Aufbau auszeichnen. Diese Giftstoffe sind nämlich Heptapeptide, setzen sich also aus nur sieben Aminosäuren zusammen, die zudem auch noch zyklisch organisiert sind, also einen Ring bilden.
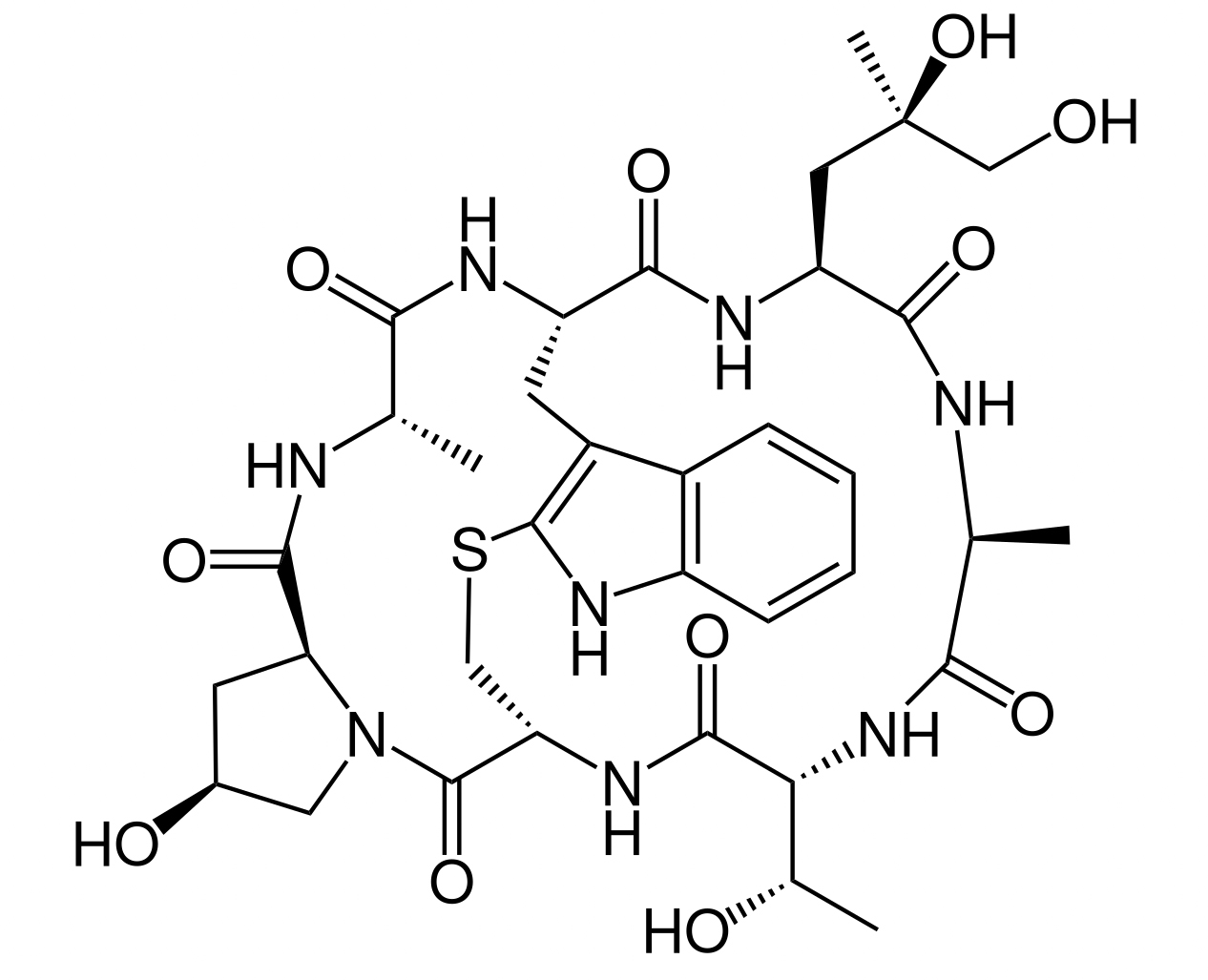
Strukturformel von Phalloidin
Autor: Chem Sim 2001, Lizenz: Public Domain.
Quellen:
- Plattner, Hentschel. Zellbiologie, 5. Auflage. Stuttgart 2017.
- Savada, Hillis, Heller, Hacker: Purves Biologie, Springer Verlag Deutschland 2019, 10. Auflage. Herausgegeben von Jürgen Markl.
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Urry, Cain, Wassermann, Minorsky, Reece. Campbell Biologie, Hallbergmoos 2019, 11.Auflage.
- engl. Wikipedia, Artikel "Actin".
- Alberts, Bruce et al. Lehrbuch der Molekularen Zellbiologie, 5. Auflage, Weinheim 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Kadereit , Körner, Nick, Sonnewald: Strasburger - Lehrbuch der Pflanzenwissenschaften, 38. Auflage, Springer Berlin Heidelberg 2021.
- Wikipedia, Artikel "Profilin"
- Wikipedia, Artikel "Latrunculine"
- Wikipedia, Artikel "Phallotoxin"