Histone sind eine Klasse basischer Proteine, die vor allem im Zellkern eukaryotischer Lebewesen vorkommen und die Nucleosomen bilden, um die sich die DNA-Doppelhelix windet. Jedes Nucleosom besteht aus acht Histon-Molekülen.
Synthetisiert werden die Histone vor allem kurz vor der Replikation der DNA. Insgesamt werden pro Zelle ca. 60 Millionen neuer Nucleosomen und damit 480 neue Histon-Moleküle benötigt, um die neu synthetisierte DNA zu verpacken [3].
Dieser Artikel über Histone ist recht lang, daher hier eine kleine Inhaltsübersicht:
Grundlegender Aufbau eines Histons
Histone sind relativ kurze Proteine mit ca. 100 bis 230 Aminosäuren. Ein Histon besteht aus einem zentralen Körper, der sich aus drei alpha-Helices zusammensetzt, die durch zwei Schleifen (Loops) zusammengehalten werden. Links und rechts ragen zwei relativ lange "Arme" aus dem Histon heraus, einer am NH2-Ende, einer am COOH-Ende. Diese Arme sind ca. 20 bis 30 Aminosäuren lang und enthalten überproportional viele basische Aminosäuren (Lysin, Arginin).
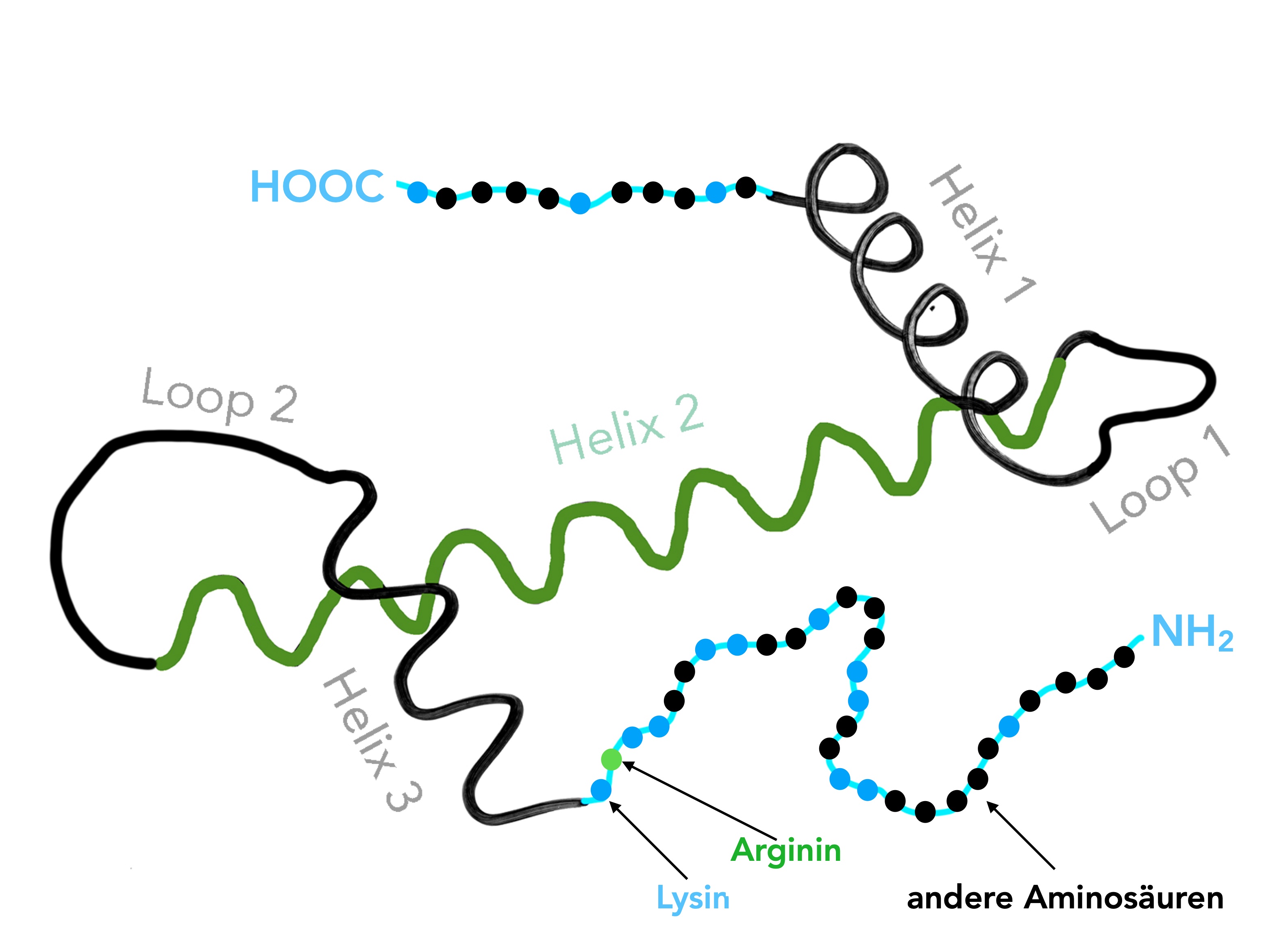
Aufbau eines Histons (H2B)
Autor: Ulrich Helmich 04/2024, Lizenz: Public domain
Dieses selbst gezeichnete Bild ist ein "Hybrid" aus einer Zeichnung auf der "The Nucleosome" - Seite von "The Lab at Penn State" und einer Abbildung im aktuellen Knippers. Das Grundgerüst aus drei alpha-Helices ist bei allen Histonen ähnlich aufgebaut, die "Arme" auf beiden Seiten unterscheiden sich in ihrer Länge, enthalten aber auf jeden Falle sehr viele basische Aminosäuren, vor allem Lysin.
Haupthistone und Subtypen
Es gibt insgesamt fünf verschiedene Haupthistone, die als H1, H2A, H2B, H3 und H4 bezeichnet werden. Die Aminosäure-Sequenzen dieser Histone sind hoch konserviert. Das Histon H4 aus tierischen Zellen unterscheidet sich beispielsweise nur durch zwei Aminosäuren von dem Histon H4 aus pflanzlichen Zellen [3]. Das zeigt, wie wichtig die Histone für das Überleben der Zellen bzw. der vielzelligen Individuen sind. Jede noch so kleine Abweichung von der idealen Aminosäuresequenz stellt einen starken Selektions-Nachteil dar.
Neben den oben genannten Haupttypen der Histone gibt es von jeder Hauptklasse mehrere Subtypen. Säugetiere haben oft mehr als 12 verschiedene Gene für jedes einzelne Histon.
Nucleosomen
Das folgende Bild zeigt ein Nucleosom, die kleinste Baueinheit der Chromosomen. Ein Nucleosom besteht aus einem Kernkomplex (Core-Komplex) von acht Histon-Molekülen. Der Core-Komplex, in dem nächsten Bild blau dargestellt, wird aus den Histonen H2A, H2B, H3 und H4 gebildet; jedes Histon kommt zweimal in dem Komplex vor. Die DNA des Chromosoms wickelt sich ca. mit 145 bis 147 Basenpaaren [1,2,5] mit 14 internen Helixwindungen [5] ca. 1,6 bis 1,7 mal um den Core-Komplex. Der gesamte Komplex hat einen Durchmesser von 10 bis 11 nm.

Die DNA windet sich um den Core-Komplex aus acht Histonen
Zephyris at the English-language Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Hier sehen Sie ein Modell eines Nucleosoms. Die DNA windet sich nicht ganz zweimal um den Kern aus acht Histonen. H2A ist in dem Bild gelb dargestellt, H2B rot, H3 blau und H4 grün. Die relativ langen Aminosäure-Ketten am N-Terminus der Histone ragen aus dem Nucleosom heraus. Diese "Arme" können leicht modifiziert werden, sie können auch Kontakt mit anderen Proteinen aufnehmen. Die Arme des Histons H4 können Kontakt mit dem H2A/H2B-Dimer im Nachbar-Nucleosom aufnehmen.
Mehr zum Thema "Nucleosomen" erfahren Sie auf dieser Lexikon-Seite.
Die einzelnen Histone
Kommen wir nun zu den einzelnen Histonen. Die meisten Histon-Gene des Menschen sind auf dem Chromosom Nr. 6 lokalisiert. Auch auf dem Chromosom Nr. 2 liegen ein paar Gene für Kern-Histone [5].
Das Histon H1
Das Histon H1 besteht aus ca. 210 bis 230 Aminosäuren, je nach Subtyp [3, S. 146]. Der Subtyp H1.0 umfasst nur 193 Aminosäuren [10].
H1 ist ähnlich aufgebaut wie die anderen Histone, besitzt also eine hoch konservierte zentrale Domäne aus drei alpha-Helices und zwei mehr oder weniger lange Arme mit vielen basischen Aminosäuren. Das Besondere an H1 ist, dass der C-terminale Arm sehr lang ist, er macht fast die Hälfte des Proteins aus.
Mit den beiden Armen nehmen die H1-Histone Kontakt mit der Linker-DNA auf, die sich zwischen den Nucleosomen befindet, und stabilisieren so die Struktur der 10-nm-"Perlenkette".
H1 ist nicht nur für die Organisation der 10-nm-Faser verantwortlich, sondern spielt auch bei der Repression der Transkription eine wichtige Rolle: "Man geht davon aus, dass durch die Histon-H1-vermittelte Verdichtung des Chromatins der Zugang für Transkriptionsfaktoren und die RNA-Polymerase verhindert wird" [9]. Durch Phosphorylierung von H1 wird das Chromatin aufgelockert, so dass Transkriptionsenzyme und -faktoren leichter Zugang zu der DNA finden können [10].
Auch bei der Kondensation / Dekondensation des Chromatins während des Zellzyklus scheint H1 eine wichtige Rolle zu spielen. Zu Beginn der Mitose sorgt H1 dafür, dass die Chromosomen lichtmikroskopisch sichtbar werden (Kondensation), nach der Mitose werden die Abstände zwischen den Nucleosomen wieder größer, so dass das Chromatin dekondensiert und im Lichtmikroskop keine Chromosomen mehr erkannt werden können.
H1 ist übrigens kein Bestandteil des Histon-Octamers, sondern sitzt quasi außen auf dem Nucleosom, was man auf dem folgenden Photo eines Fimo-Modells gut sehen kann:

Organisation eines Nucleosoms (Fimo-Modell)
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
H1-Subtypen
Laut dem DocCheck Flexikon [9] gibt es von dem Histon H1 sieben somatische Subtypen, nämlich H1.1 bis H1.5, außerdem H1.0 und H1X. Weiterhin gibt es zwei Testis-spezifische Subtypen, und zwar H1t, H1T2 und HlLS1 (also Varianten, die nur in den Hoden vorkommen), sowie einen Oocyten-spezifschen Subtyp, der als H1oo bezeichnet wird und nur in den Eizellen des Menschen vorkommt.
Medizinische Bedeutung
"Mehrere Phosphorylierungen der Subtypen H1.2–H1.5 stehen in Zusammenhang mit der Tumorprogression und einer schlechten Prognose bei Krebserkrankungen." [9]
Die Histone H2A und H2B
Es gibt im menschlichen Genom 12 Gene für die H2A-Histone [3] (129 Aminosäuren [6]) und sogar 14 Gene für die H2B-Histone (125 Aminosäuren).
Histon H2A
Von den 12 H2A-Histon-Genen codieren sechs Proteine mit den gleichen Aminosäuresequenzen, die Proteine dieser sechs Gene sind also völlig identisch. Durch das Vorhandensein von sechs identischen Genen - vermutlich durch mehrfache Genduplikation entstanden [3, 6] - wird die Transkriptionsrate dieser Histon-Gene um den Faktor sechs erhöht - eine Reaktion der Evolution auf den immensen Histon-Bedarf vor jeder Replikationsrunde der DNA.
Die anderen sechs H2A-Gene produzieren leicht unterschiedliche Histone, die sich aber nur an zwei oder drei Positionen unterscheiden.
Histon H2B
Für das H2B-Histon gibt es sogar 14 Gene in dem menschlichen Genom. Vier dieser Gene produzieren identische H2B-Proteine, bei den anderen zehn Genen unterscheiden sich die Aminosäuresequenzen nur leicht.
Die Histone H3 und H4
Histon H4
14 Gene sind im Humangenom für das Histon H4 (102 Aminosäuren) zuständig, und alle 14 Gene produzieren die gleiche Aminosäure-Sequenz.
Histon H3
Für das Histon H3 (135 Aminosäuren) gibt es noch mehr Gene, weil es von diesem Histon mehrere Subtypen gibt, die als H3.1 (10 Gene), H3.2 (3 Gene), H3.3 (2 Gene), H3.4, H3.5, H3.X und H3.Y bezeichnet werden. [8].
Die H3-Histone werden wie alle Histone posttranslational modifiziert, aber bei H3 sind diese Modifikationen am stärksten ausgeprägt.
Chemische Modifizierung von Histonen
Seit Mitte der 90er Jahre weiß man, dass Histone nicht nur bei der Kondensation der DNA, also beim "Verpacken" eine wichtige Rolle spielen, sondern auch bei der Genregulation. Die Histone können durch bestimmte Enzyme chemisch verändert werden, beispielsweise können Methylgruppen, Phosphatgruppen oder Acetylgruppen eingebaut werden (Histonmodifikation). Die Modifizierung von Lysin-, Arginin- oder Serin-Seitenketten beschränkt sich nicht nur auf die langen "Arme" bzw. "Schwänze" der Histone, sondern auch auf die Aminosäuren in den drei alpha-Helices im Kern der Histone [1].
Acetylierung
Bei der Acetylierung wird eine CO-CH3-Gruppe auf die Seitenkette von Lysin übertragen.
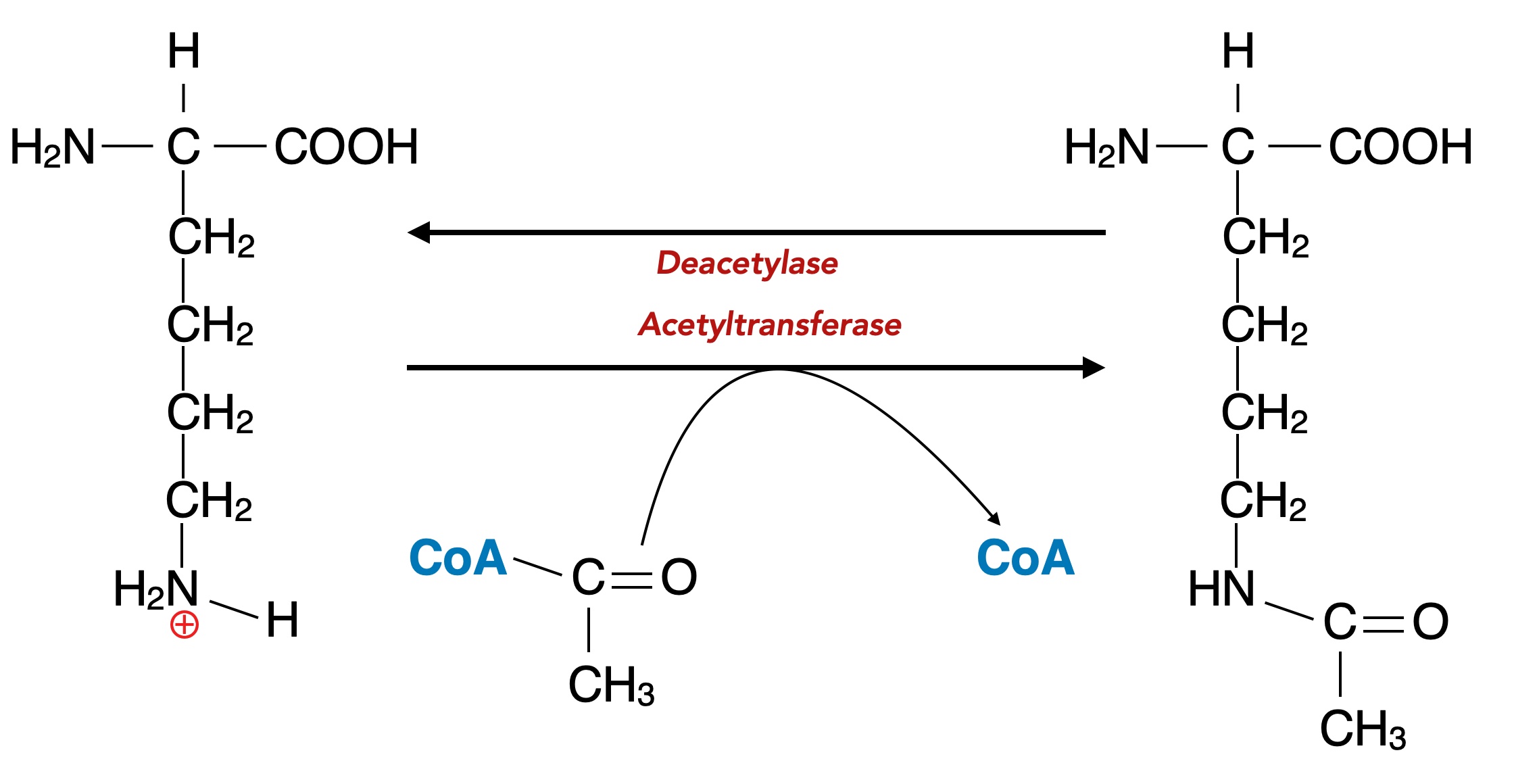
Acetylierung von Lysin-Seitenketten
Autor: Ulrich Helmich 04/2024, Lizenz: Public domain
Das dafür verantwortliche Enzym ist eine Acetyltransferase. Im Zellkern sorgen spezielle Histon-Acetyltransferasen (HATs) für diese Acetylierung. Wie immer entstammt die erforderliche Acetylgruppe einem acetylierten Coenzym A - Molekül, also Acetyl-CoA.
Auch der umgekehrte Prozess findet immer wieder statt, die Deacetylierung. Für diese Reaktion ist dann eine Deacetylase zuständig.
Die Acetylierung/Deacetylierung ist also keine Gleichgewichtsreaktion, die von ein- und demselben Enzym katalysiert wird, sondern es sind zwei im Prinzip voneinander unabhängige Reaktionen. Daher wurden in der Zeichnung oben auch keine Gleichgewichtspfeile verwendet.
Die Acetylierung von Histon-Armen lockert das Chromatin auf, so dass Transkriptionsfaktoren und -enzyme leichter auf die DNA zugreifen können.
Die Auflockerung kommt dadurch zustande, dass vorhandene positiv geladene NH3+-Gruppen in Lysin-Seitenketten durch die Acetylierung verschwinden. Vorhandene Ionenbindungen zwischen NH3+-Gruppen und COO--Gruppen werden damit aufgelöst.
Methylierung
Bei der Methylierung wird ein Wasserstoff-Atom der NH3+Gruppe in einer Lysin-Seitenkette durch eine CH3-Gruppe ersetzt; die positive Ladung bleibt dabei erhalten:
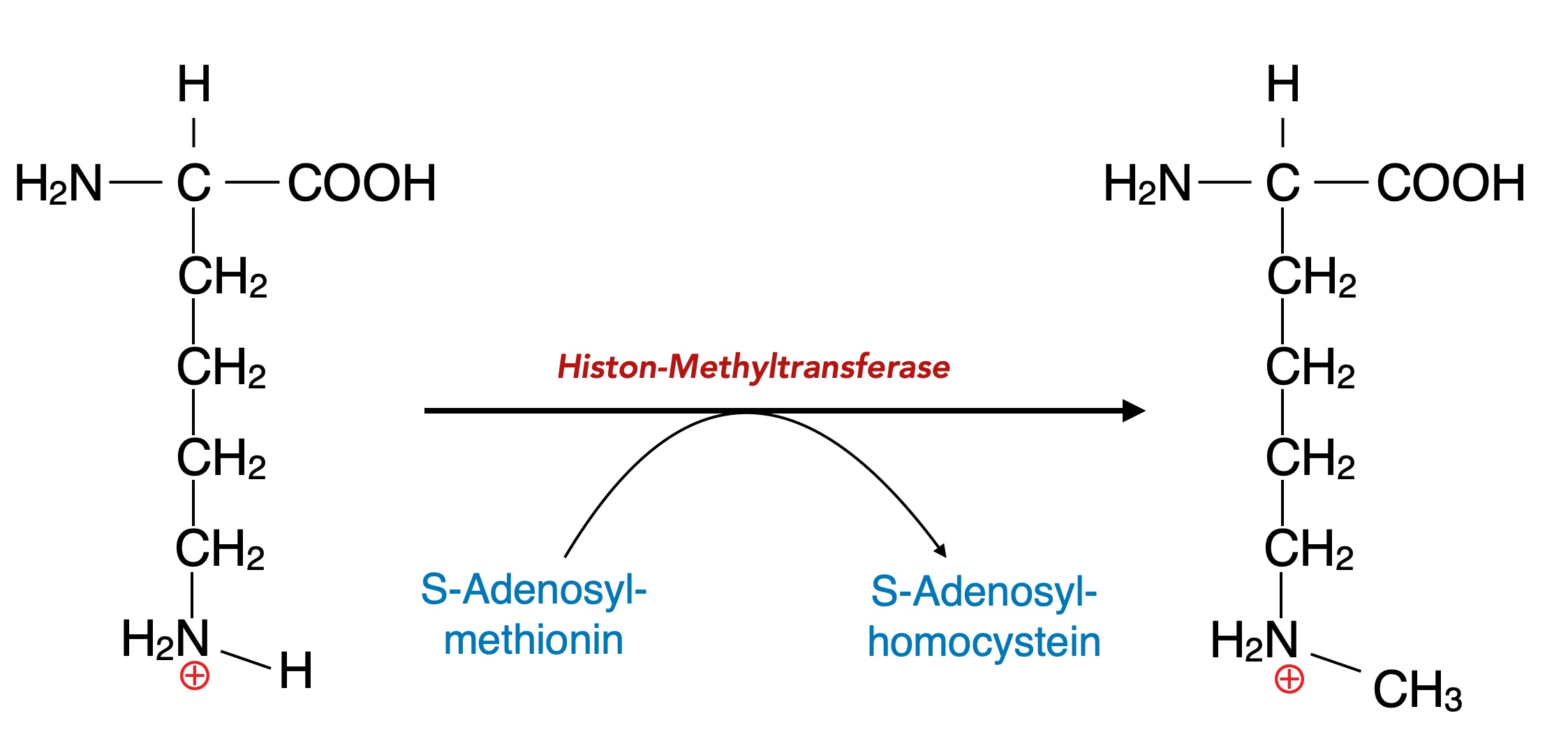
Methylierung von Lysin in einem Histon-Arm
Autor: Ulrich Helmich 04/2024, Lizenz: Public domain
Die umgekehrte Reaktion, die Entfernung einer Methylgruppe, wird ähnlich wie bei der Acetylierung durch ein anderes Enzym katalysiert, nämlich durch eine Histon-Demethylase.
Zwei- und dreifache Methylierung
Es können auch zwei oder sogar drei H-Atome der NH3+Gruppe durch Methylgruppen ersetzt werden, es entstehen dann Dimethyl- bzw. Trimethyl-Lysin-Seitenketten.
"Die Trimethylierung eines spezifischen Lysins auf dem H3-Histon-Schwanz ... trägt zur Errichtung und Ausbreitung des Heterochromatins bei." [1, S. 219]
Methylierung von Arginin
Auch die Seitenketten der Aminosäure Arginin können methyliert werden, allerdings kommt laut [1] diese Form der Methylierung bei Histonen nicht vor. Siehe dazu jedoch den Artikel "Histone methyltransferase" in der engl. Wikipedia. Hier werden drei Klassen von Histon-Methyltransferasen unterschieden, zwei sind für die Methylierung von Lysin verantwortlich, die dritte für die Methylierung von Arginin:
"There are three different types of protein arginine methyltransferases (PRMTs) and three types of methylation that can occur at arginine residues on histone tails" [11]
Phosphorylierung von Serin
Serin ist eine einfache Aminosäure mit einem -CH2-OH-Rest. Die OH-Gruppe von Serin kann mit einem Phosphorsäure-Molekül verestern, es bildet sich dann phosphoryliertes Serin. Die Phosphatgruppe stammt von einem ATP-Molekül, zurück bleibt dann ADP. Katalysiert wird die Serin-Phosphorylierung durch Kinasen (Hinzufügen einer Phosphatgruppe) bzw. durch Phosphatasen (Abtrennen einer Phosphatgruppe).
Das Hinzufügen einer negativ geladenen Phosphatgruppe lockert das Chromatin stark auf, denn die Phosphatgruppen der modifizierten Histone und die Phosphatgruppen der DNA stoßen sich gegenseitig ab.
Quellen:
- Alberts et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Knippers, Molekulare Genetik, Stuttgart 2015.
- Spektrum-Lexikon der Biologie, Artikel "Histon-Acetylierung".
- Graw: Genetik, 7. Auflage, Springer Spektrum, Berlin 2021.
- Römpp Chemie Lexikon Band 3 H-L, 9. Auflage, Thieme-Verlag Stuttgart 1990.
- Graziano, Gerchmann, Schneider, Ramakrishnan: "Histone H1 is located in the interior of the chromatin 30-nm filament" in Nature vom 24. März 1994.
- engl. Wikipedia, Artikel "Histone_H3",
- DocCheck Flexikon, Artikel "Histon H1".
- Wikipedia, Artikel "Histon H1"
- engl. Wikipedia, Artikel "Histone methyltransferase"