Proteingehalt
Der Gehalt an Eiweiß in Vollmilch liegt bei 3,5%, hat also einen ähnlichen Wert wie der Fettgehalt. 80% dieser 3,5% bestehen aus verschiedenen Caseinen, die restlichen 20% sind sogenannte Molkenproteine.
Durch einen einfachen Versuch kann man zeigen, dass in der Milch zwei unterschiedliche Proteinfraktionen enthalten sind. Man gibt etwas Essigsäure in ein Becherglas mit Vollmilch, und nach kurzer Zeit wird die Milch flockig. Diese Flocken, die man leicht abfiltrieren kann (manchmal reicht auch ein feines Sieb) bestehen aus Casein. Die Molkenproteine denaturieren nicht durch Zugabe von Säure und bleiben in der Lösung bzw. im Filtrat. Die Molkenproteine kann man dann durch Erhitzen des Filtrats ausflocken und abtrennen.
Caseine
Caseine (sprich: Kase-in, kommt aus dem lateinischen caseus für Käse) machen den Hauptanteil der Milchproteine aus, ca. 80% der Milchproteine gehören zur Gruppe der Caseine, die wiederum zu den Phosphoproteinen gehören (Proteine, die mit einer oder mehreren Phosphatgruppen verbunden sind).
Es gibt insgesamt vier verschiedene Caseine, nämlich $\alpha$S1-, $\alpha$S2-, $\beta$- und $\kappa$-Casein. Das $\alpha$S1-Casein ist mit 10,7g/Liter das häufigste Protein in der Kuhmilch, gefolgt vom $\beta$-Casein mit 8,6g/Liter. Die vier Caseine sind recht kurze Proteine, sie bestehen aus 169 ($\kappa$-Casein) bis 209 ($\beta$-Casein) Aminosäuren. Für jedes dieser vier Caseine ist in der Kuh (und übrigens auch im Menschen) ein eigenes Gen verantwortlich. Beim Menschen liegen diese vier Gene auf dem Chromosomen Nr. 4.
Caseinmicellen
Laut dem "Kurzen Lehrbuch Milchkunde und Milchhygiene" von Rupert M. Bruckmaier besteht ca. 95% des Caseins aus Micellen, also kleinen kugelförmigen Aggregaten, die jeweils Tausende von Casein-Molekülen enthalten. In einem Milliliter Kuhmilch befinden sich schätzungsweise $10^{14}$ solcher Micellen. Nach Bruckmaier ist die treibende Kraft für die Bildung dieser Micellen die Tatsache, dass die Caseine keine Sekundär- und Tertiärstrukturen bilden können, sondern in Form langer Peptidketten vorliegen, die sich dann durch hydrophobe Wechselwirkung zu den Micellen zusammenlagern. Dieser Prozess erfolgt auf mehreren Ebenen. Zunächst werden "submicelläre Strukturen aufgebaut". Die einzelnen Casein-Moleküle werden durch die Phosphatreste der Phosphoproteine zusammengehalten:
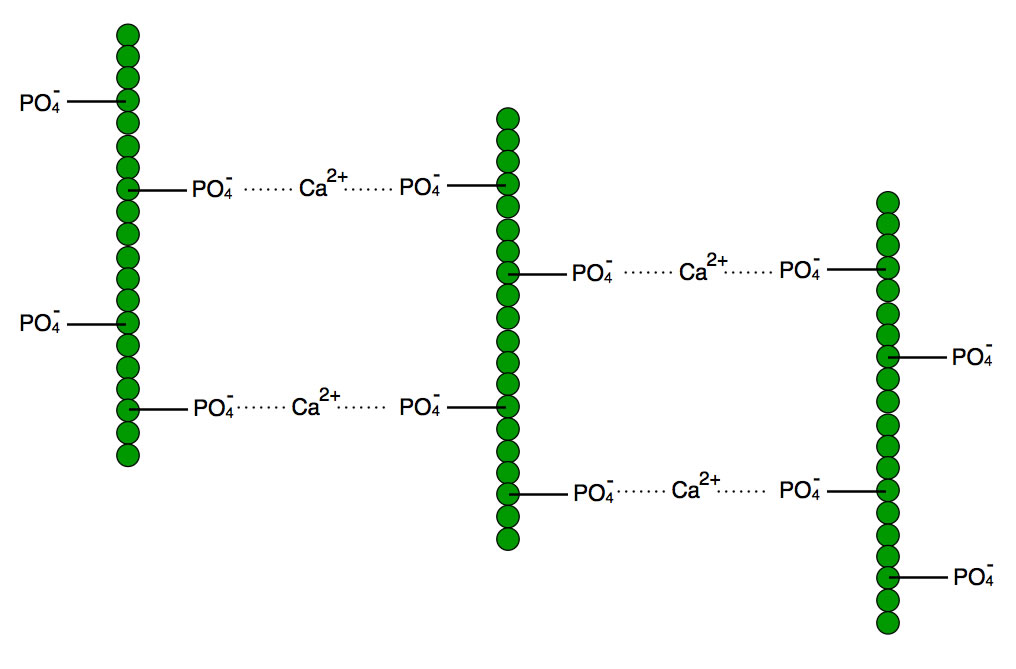
Hier sehen Sie eine ganz naive Vorstellung, wie die einzelnen Casein-Moleküle (grüne Kugeln = Aminosäuren) durch Phosphat-Calcium-Bindungen zusammengehalten werden. Ein kleiner Teil der Aminosäuren der Caseine ist mit Phosphatgruppen verestert, die ja bekanntlich negative Ladungen tragen. Calcium-Ionen andererseits sind zweifach positiv geladen. Daher sind es im Grunde die Calcium-Ionen, welche die einzelnen Proteinfäden zusammenhalten.
Vollmilch gilt gerade für Kinder als sehr gesund. Einer der Gründe dafür ist der hohe Gehalt an Calcium und Phosphat. Beide Mineralien werden für das Wachstum vor allem der Knochen und Zähne benötigt; und Phosphat ist außerdem ein wichtiger Bestandteil unserer DNA.
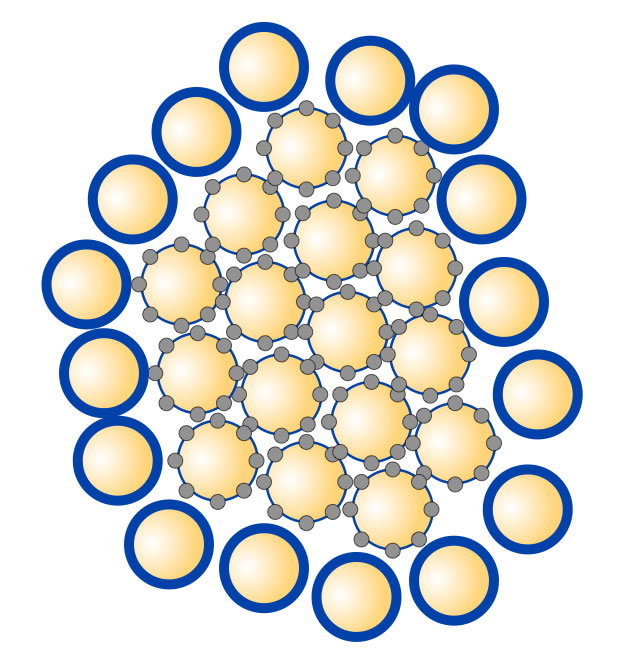
Hier sehen Sie wieder eine ganz einfache Vorstellung vom Aufbau einer Micelle. 400 bis 500 Submicellen bilden eine Casein-Micelle. Im Innern einer Submicelle befinden sich die hydrophoben Anteile der Proteinketten (gelb gezeichnet), während außen die eher hydrophilen Aminosäuren sind. Die Phosphat-Calcium-Brücken sind hier durch die kleinen grauen Kreise veranschaulicht. Diese Brücken halten die einzelnen Submicellen zusammen. Im Außenbereich der gesamten Micelle befinden sich Submicellen mit einem hohen Anteil an $\kappa$-Casein (blau dargestellt). Weitere Einzelheiten zu diesem Thema finden Sie auf der sehr ausführlichen ChemgaPedia-Seite "Die Micellenbildung des Caseins". Eine sehr schöne Abbildung findet man auch auf der entsprechenden Seite von www.food-info.net.
Molkenproteine
Molkenproteine sind hauptsächlich Albumine und Globuline. Die folgende Tabelle zeigt die Zusammensetzung der Molkenproteine (nach deGroot, Ernährungswissenschaft , 5. Auflage 2011):
| Protein | Anteil im Molkenprotein |
| $\beta$-Lactoglobulin | 45% |
| $\alpha$-Lactalbumin | 20% |
| Proteose-Pepton | 20% |
| Immunoglobuline | 10% |
| Serumalbumin | 5% |
Die biologische Wertigkeit dieser Molkenproteine ist sehr hoch, da sie viele essentielle Aminosäuren in optimaler prozentualer Zusammensetzung enthalten. Deswegen kann man auch Molkenprotein-Konzentrat kaufen; Sportler verwenden es als Nahrungsergänzungsmittel für den Muskelaufbau.
Die Molkenproteine sind sehr hitzeempfindlich. Wenn man Milch aufkocht, entsteht bekanntlich eine Haut auf der Oberfläche. Dafür sind vor allem die Molkenproteine verantwortlich.
Das $\beta$-Lactoglobulin von Kühen und Schafen kann beim Menschen als Allergen wirken, also eine Allergie auslösen (Milcheiweiß-Allergie; nicht zu verwechseln mit Lactose-Intoleranz). Aber auch verschiedene Caseine und das $\alpha$-Lactalbumin sind mögliche Allergene.