Definition
Redoxpotenzial
Die Fähigkeit eines Elektronen-Donators zur Abgabe von Elektronen, gemessen in Volt.
Das ist quasi die Kurzdefinition des Begriffs, die jeder Schüler (m/w/d) verstehen müsste. Wir wollen diese Kurzdefinition mit den gängigen Definitionen von zwei seriösen Quellen vergleichen, dem RÖMPP Chemie-Lexikon und dem Spektrum Lexikon der Chemie.
"Redoxpotenzial ... Bez. für das in Volt ausgedrückte Potential (Redoxspannung) eines Redoxsystems gegen die Normalwasserstoff-Elektrode bzw. eine andere Bezugselektrode"[1].
Das Spektrum-Lexikon der Chemie enthält leider keinen Eintrag zum Thema Redoxpotenzial; auch wenn man den Begriff Elektrodenpotenzial nachschlägt, findet man nur einen Verweis auf den Artikel "elektrochemisches Gleichgewicht"[2]. Allerdings findet man im Lexikon der Biologie eine interessante Definition:
"Redoxpotential ... physikochemisch definierter Begriff, der in unmittelbarem Zusammenhang mit den bei Redoxreaktionen (auch zellulären) freiwerdenden Energien steht und daher als Maßeinheit für diese verwendet wird..."[3].
Messung des Redoxpotenzials
In der Schule kann man Redoxpotenziale relativ einfach messen, indem man zwei Standard-Halbzellen miteinander kombiniert und mit einem Voltmeter die Spannung misst, die zwischen ihnen herrscht. Allerdings misst man dann nicht die Redoxpotenziale selbst, sondern nur den Redoxpotenzial-Unterschied.
Beispiel Kupfer - Eisen
Eisen, genauer gesagt das Redoxpaar Fe/Fe2+ hat das Standardpotenzial -0,41 V (bei 25 ºC , 101,3 kPa, c(Fe2+) = 1 mol/l und pH = 0). Das Redoxpaar Cu/Cu2+ hat unter diesen Bedingungen das Standardpotenzial +0,35 V. Kombiniert man eine Eisen-Halbzelle mit einer Kupfer-Halbzelle, so erhält man unter Standardbedingungen eine Spannung von 0,76 V, wobei die Eisen-Halbzelle den Minuspol bildet.
Standard-Wasserstoffhalbzelle
Eine direkte Bestimmung des Redoxpotenzials ist mit der Standard-Wasserstoffelektrode möglich, deren Redoxpotenzial definitionsgemäß bei exakt 0 V liegt. Kombiniert man diese H2-Halbzelle beispielsweise mit einer Cu-Halbzelle, so erhält man eine Spannung von genau 0,35 Volt.
Andere Referenzelektroden
Wenn man das Redoxpotenzial einer Halbzelle bereits genau kennt, so kann man das Redoxpotenzial einer anderen Halbzelle leicht bestimmen, wenn man diese beiden Halbzellen zusammenschaltet und dann die Spannung misst, die zwischen diesen Halbzellen herrscht. Im Idealfalls geschieht die Messung unter Standardbedingungen. Falls keine Standardbedingungen vorliegen, so lässt sich das Redoxpotenzial aus dem gemessenem Wert und den abweichenden Faktoren berechnen, zum Beispiel mit Hilfe der Nernst-Gleichung.
Abhängigkeit des Redoxpotenzials von Außenfaktoren
Das Redoxpotenzial eines Stoffes hängt von mehreren Faktoren ab, von denen Druck, Temperatur, pH-Wert und Konzentration der korrespondierenden Kationen / Anionen die wichtigsten sind. Für den Chemie-Unterricht in der Schule ist sicherlich die Konzentrationsabhängigkeit des Redoxpotenzials wichtig, die mit einfachen Versuchen nachgewiesen werden kann und dann schnell zur Nernst-Gleichung hinführt. Auch die Temperaturabhängigkeit des Redoxpotenzials kann übrigens mit der Nernst-Gleichung berechnet werden.
Abhängigkeit des Redoxpotenzials von "Innenfaktoren"
Der Begriff "Innenfaktoren" ist jetzt nur ein Behelf. Gemeint ist die Frage, warum ist bei manchen Stoffen das RP eigentlich sehr groß (bzw. sehr negativ), bei anderen Stoffen dagegen sehr klein (bzw. sehr positiv). Oder einfacher formuliert, wieso hat beispielsweise Zink ein negativeres RP als Eisen, Kupfer oder Silber?
Ionisierungsenergie
Ein Metall kann andere Metalle reduzieren, wenn es Elektronen abgibt. Daher liegt die Vermutung nahe, dass das RP eines Metalls mit der Ionisierungsenergie zusammenhängt. Metalle mit geringer Ionisierungsenergie sollten auch recht negative RP haben. Das kann man leicht überprüfen.
| Metall | Ionisierungsenergie in eV | Redoxpotenzial (Standardpotenzial) |
| Lithium | 5,4 | -3,04 |
| Magnesium | 7,6 | -2,36 |
| Eisen | 7,9 | -0,41 |
| Zink | 9,4 | -0,76 |
| Kupfer | 7,7 | +0,34 |
| Silber | 7,6 | +0,80 |
| Gold | 9,2 | +1,50 |
Auf den ersten Blick scheint da ein Zusammenhang zu bestehen. Das Metalle mit der geringsten Ionisierungsenergie - Lithium - hat auch das negativste RP, und das Metallmit der höchsten Ionisierungsenergie - Gold - hat das positivste RP. Moment - da stimmt etwas nicht! Zink hat hier die höchste Ionisierungsenergie, aber ein recht negatives RP.
Eine graphische Darstellung der Korrelation Ionisierungsenergie - Redoxpotenzial soll hier etwas Klarheit schaffen:
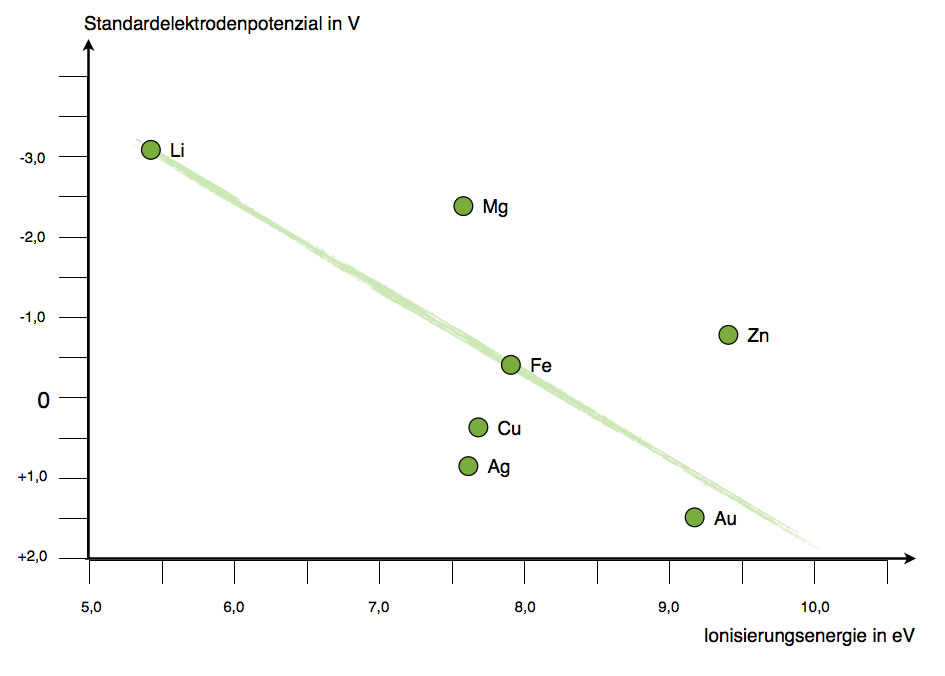
Korrelation Ionisierungsenergie - Redoxpotenzial
Man kann zwar eine Art Ausgleichsgerade durch die sieben Punkte ziehen, aber das Ganze ist doch sehr gewagt und ungenau. Die Regel "je höher die Ionisierungsenergie, desto positiver das Redoxpotenzial" scheint zwar auf den ersten Blick zu stimmen, doch es gibt einfach zu viele Ausnahmen davon.
Schlussfolgerung: Die Ionisierungsenergie könnte einer der Faktoren sein, die das RP beeinflussen, aber sie ist mit Sicherheit nicht der einziger Fakor.
Elektronenaffinität
Wie sieht es mit der Elektronenaffinität aus? Unter diesem Begriff versteht man die Differenz zwischen dem Grundzustand eines neutralen Atoms und dem Grundzustand des entsprechenden Anions. Manchmal wird die Elektronenaffinität auch als negative Ionisierungsenergie definiert, also als die Energie, die notwendig ist, einem negativen Anion ein Elektron zu entreißen.
| Metall | Elektronenaffinität in kJ/mol | Redoxpotenzial (Standardpotenzial) |
| Lithium | -60 | -3,04 |
| Magnesium | +19 | -2,36 |
| Eisen | -16 | -0,41 |
| Zink | +47 | -0,76 |
| Kupfer | -118 | +0,34 |
| Silber | -126 | +0,80 |
| Gold | -223 | +1,50 |
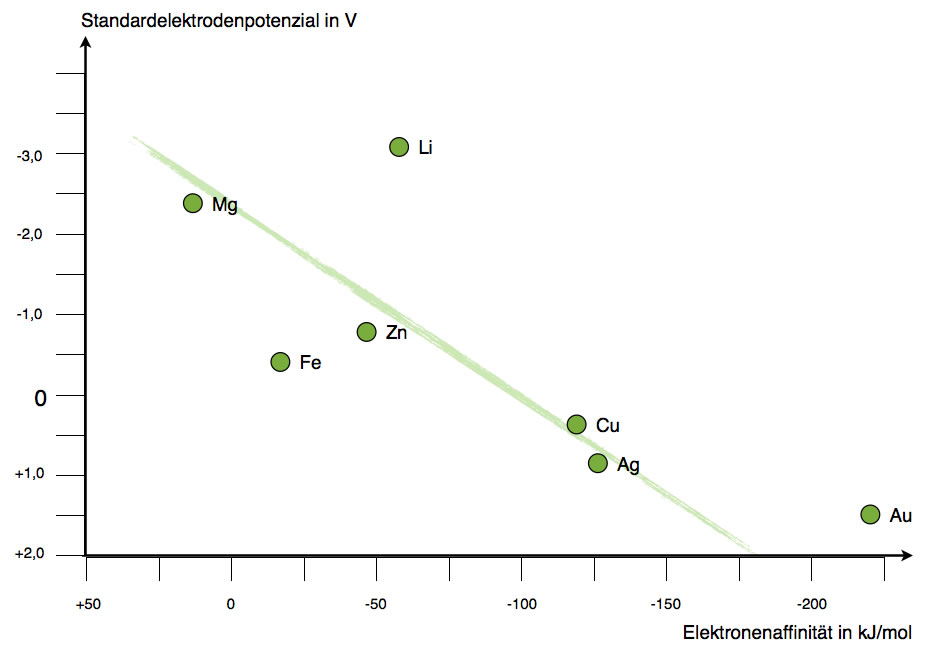
Korrelation Elektronenaffinität - Redoxpotenzial
Hier erleben wir fast die gleiche Situation wie bei dem Zusammenhang zwischen Redoxpotenzial und Ionisierungsenergie. Auf den ersten Blick besteht ein grober Zusammenhang, es gibt aber viele Ausnahmen. Aber es ist schon einleuchtend: Ein Metall, das "gerne" zusätzliche Elektronen aufnimmt, also eine große (negative) Elektronenaffinität hat, ist umgekehrt wenig bereit, ein Elektron an einen Elektronen-Akzeptor abzugeben.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 5 1992
- Spektrum Lexikon der Chemie, 1998
- Spektrum Lexikon der Biologie, 1999