Allgemeines
Die Ionenbindung (ionische Bindung, heteropolare Bindung) gehört zu den starken chemische Bindungen, sie beruht auf elektrostatischen Anziehungskräften zwischen positiv geladenen Kationen und negativ geladenen Anionen.
Schulbuchbeispiel NaCl
Das klassische Beispiel für eine Ionenbindung ist die Bildung von Natriumchlorid aus Natrium und Chlor.
Das Natrium-Atom hat auf seiner Außenschale nur ein Valenzelektron, das sehr leicht abgegeben werden kann, was man beispielsweise an der sehr geringen ersten Ionisierungsenergie des Natriums sieht. Durch Abgabe des Außenelektrons erlangt das Natrium-Atom die gleiche Elektronenkonfiguration wie das Edelgas Argon, das Na+-Kation ist daher sehr stabil (Oktettregel, Edelgasregel).
Das Chlor-Atom tritt bei dieser Reaktion als Elektronen-Akzeptor auf (Donator-Akzeptor-Prinzip). Dem Chlor-Atom fehlt genau ein Elektron, um in den Edelgaszustand des Argon-Atoms zu kommen. Durch Aufnahme eines Elektrons wird aus dem Chlor-Atom ein negativ geladenes Chlorid-Anion.
Die positiven Natrium-Ionen und die negativen Chlorid-Ionen ziehen sich nun gegenseitig sehr stark an; bei diesem Prozess wird recht viel Energie freigesetzt, die sogenannte Gitterenergie. Es bildet sich ein Salzkristall, und in dieser Kristallstruktur zieht jedes Natrium-Ion sechs Chlorid-Ionen an, gleichzeitig zieht jedes Chlorid-Ion sechs Natrium-Ionen an. Die Folge dieser gegenseitigen starken Anziehung ist die Bildung eines regelmäßigen Kristallgitters.
Kationen und Anionen
Kationen-Bildung
Grundsätzlich ist es so, dass Elemente mit nur ein oder zwei Außenelektronen zur Bildung von Kationen neigen, weil hier der energetische Aufwand zum Erreichen des Edelgaszustands recht gering ist. Nicht alle Metalle sind automatisch Kationen-Bildner, aber doch die meisten, vor allem die Alkali- und Erdalkalimetalle, Aluminium und viele Metalle der Nebengruppen wie zum Beispiel Zink, Eisen, Kupfer oder Silber.
Anionen-Bildung
Elemente, denen nur ein oder zwei Elektronen zur Vervollständigung ihrer Außenschale fehlen, neigen zur Anionen-Bildung. Vor allem sind dies die Nichtmetalle der sechsten und siebten Hauptgruppe des PSE.
Mehratomige Ionen
Nicht nur Elemente können Kationen oder Anionen bilden, sondern auch Gruppen von Atomen. Bekannte mehratomige Anionen sind beispielsweise das Sulfat-Anion SO42-, das Nitrat-Anion NO3- oder das Phosphat-Anion PO43-. Aber auch Metall-Atome können das Zentrum eines solchen Anions bilden, zum Beispiel beim Permanganat-Ion MnO4-. Ein bekanntes mehratomiges Kation ist das Ammonium-Ion NH4+ mit einem Nichtmetall als Zentralatom.
Übergang zwischen Ionenbindung und kovalenter Bindung
Die reine unpolare kovalente Bindung und die reine Ionenbindung sind zwei Extremfälle auf einer kontinuierlichen Skala von starken chemischen Bindungen. Betrachten wir dazu die folgende Graphik:
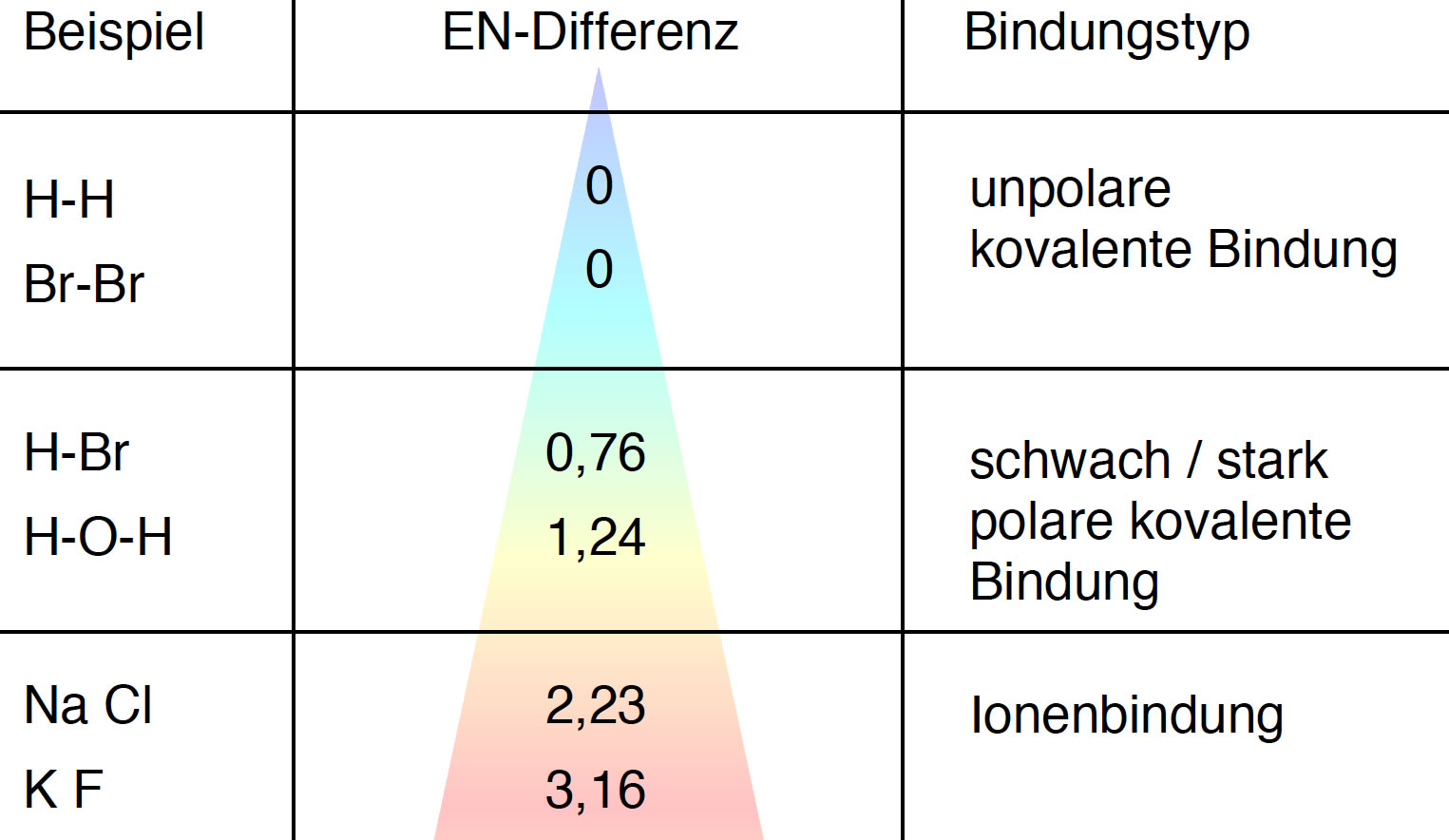
Auswirkung der EN-Differenz auf die chemische Bindung
Autor: Ulrich Helmich 2020, Lizenz: Public domain
Diese Abbildung zeigt, dass es auf die EN-Differenz zwischen den an der Bindung beteiligten Atomen ankommt.
Ist die EN-Differenz Null (bei zwei gleichen Atomen wie H2, O2, Br2 oder N2 zum Beispiel), dann liegt eine völlig unpolare kovalente Bindung vor.
Auch wenn die EN-Differenz sehr klein ist wie beispielsweise bei den C- und H-Atomen der Alkane, spricht man noch von einer unpolaren kovalenten Bindung.
Bei einer etwas größeren EN-Differenz zwischen ca. 0,7 und 1,3 bildet sich eine polare kovalente Bindung.
Erst wenn die EN-Differenz größer ist als 1,7 gibt das eine Atom seine Außenelektronen vollständig an das andere Atom ab, und es entsteht eine Ionenbindung.
Aber wie bereits gesagt gibt es hier durchaus Übergangsformen zwischen polarer kovalenter Bindung und Ionenbindung.
Quantitative Betrachtungen
Die Wechselwirkungsenergie E zwischen einem Kation und einem Anion wird durch folgende Formel bestimmt [1]:
$E = E_{Anz} + E_{Abst} = \frac{z^{+}z^{-}e^{2}}{4 \pi \epsilon_0r} + \frac{b}{r^{n}}$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Dabei sind z+ und z- die Ladungen des Kations und Anions und r der Abstand zwischen den beiden Teilchen. Die anderen Symbole stehen für bestimmte Konstanten, die uns hier nicht weiter interessieren.
Die Wechselwirkungsenergie E setzt sich aus zwei Komponenten zusammen, der Coulombschen Anziehung und der Bornschen Abstoßung. Dass sich positive und negative Ionen anziehen, ist eigentlich klar, auch dass die Stärke der Anziehung mit den Ladungen größer wird. Außerdem hängt die Stärke der Anziehung von der Entfernung r der Ionen ab, je größer die Entfernung r, desto geringer die Stärke der Anziehung bzw. die Anziehungsenergie.
Wenn sich die Elektronenhüllen der beiden Ionen jedoch zu nahe kommen, muss man auch eine Abstoßungskraft berücksichtigen, denn die negativen Elektronen der Hüllen stoßen sich ja gegenseitig ab. Dieser Faktor wird in dem zweiten Term in der obigen Gleichung berücksichtigt. Allerdings fließt hier die Entfernung der Teilchen mit einem Exponenten n von 7 bis 12 ein, abhängig von den beteiligten Ionen [2].
Auf dieser Seite - ursprünglich für Schüler(innen) der Jahrgangsstufe 9/10 geschrieben, wird die Bildung von Natriumchlorid aus festem Natrium und gasförmigem Chlor eingehend beschrieben. Begriffe wie Sublimationsenergie, Ionisierungsenergie, Elektronenaffinität etc. werden dabei erklärt.
Kristallbildung und Dissoziation
Die positive Ladung eines Kations erzeugt ein radiärsymmetrisches elektrisches Feld, das Anionen, anzieht. Umgekehrt erzeugt die negative Ladung eines Anions ein elektrisches Feld, das Kationen in der näheren Umgebung anzieht. Als Folge dieser gegenseitigen Anziehung entstehen bei niedrigen Temperaturen regelmäßig aufgebaute Kristalle, in denen sich die Kationen und Anionen regelmäßig abwechseln.
Beim NaCl-Kristall beispielsweise ist jedes Na+-Ion von sechs Cl--Ionen umgeben, und jedes Cl--Ion hat sechs Na+-Ionen als Nachbarn.
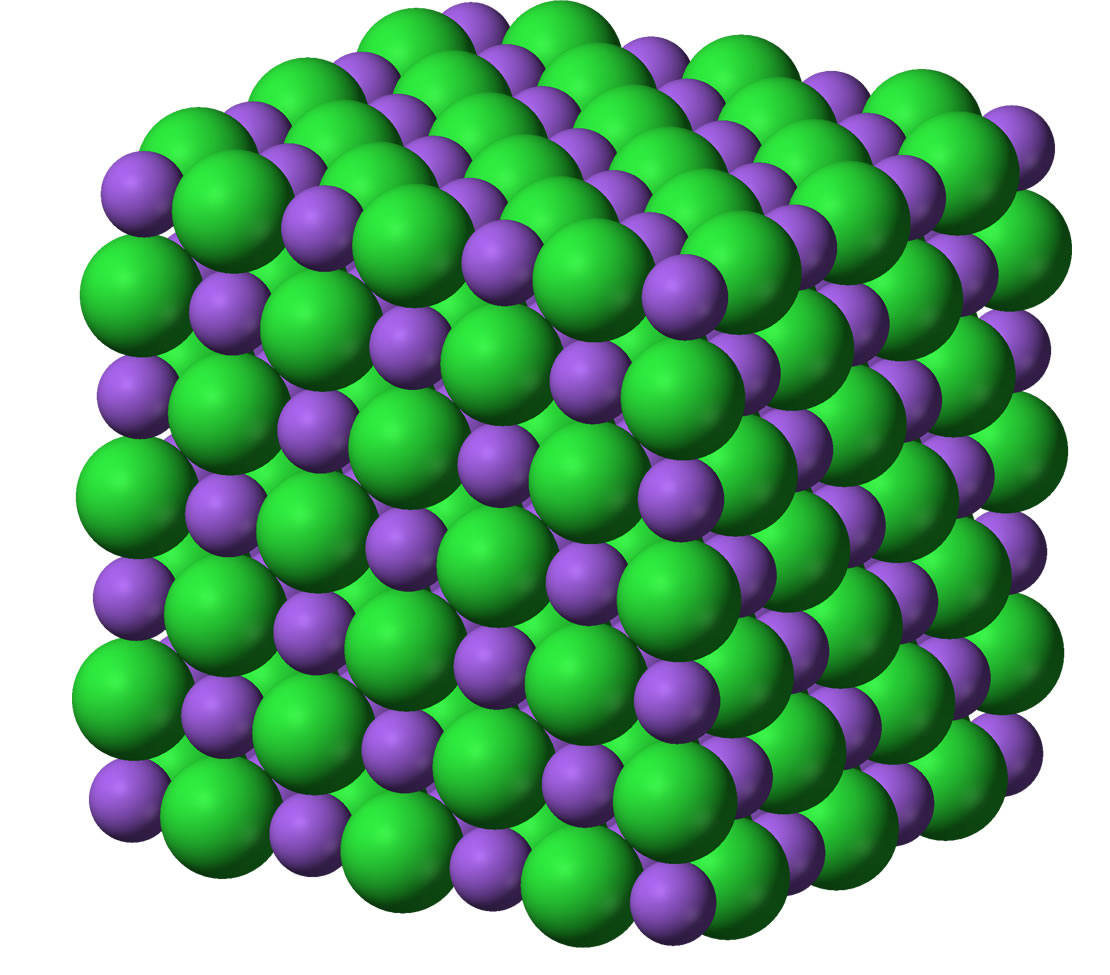
Die Kristallstruktur von Natriumchlorid mit Natrium-Ionen in violett und Chlorid-Ionen in grün.
Quelle: englische Wikipedia. Autor: Benjah-bmm27. Lizenz: Public domain.
Andere Ionenverbindungen bilden ebenfalls Kristalle, allerdings können diese eine völlig andere - aber auf jeden Fall regelmäßige - Struktur besitzen. Die genaue Struktur eines Salzkristalls hängt vor allem von der Größe der Ionen bzw. von den Größen-Unterschieden zwischen Kationen und Anionen ab.
Auf dieser Seite finden Sie Abbildungen und Beschreibungen weiterer Kristallstrukturen, nämlich von Zinksulfid und Cäsiumchlorid.
Quellen:
- Spektrum Lexikon der Chemie, Artikel "chemische Bindung"
- Römpp Chemie-Lexikon, 9. Auflage 1992, Artikel "chemische Bindung"