Abitur
Einige der auf dieser Seite behandelten Themen werden in folgenden Abituraufgaben aufgegriffen:
- 2021-GK-HT 2: "Blausäure - schwache Säure, starkes Gift"
Blausäure HCN
Blausäure ist eine Lösung von Cyanwasserstoff HCN in Wasser. Reine Blausäure ist flüssig und liegt dann in Form von Dimeren (HCN)2 vor [1].
Eigenschaften
Reine Blausäure ist eine farblose, brennbare, recht flüchtige und unbegrenzt mit Wasser mischbare Flüssigkeit. Der Siedepunkt liegt bei 26 ºC.
Giftigkeit
Die wohl bekannteste Eigenschaft ist jedoch die enorme Giftigkeit der Blausäure, was oft für heimtückische Morde eingesetzt wurde, auch für Massenmorde im Nationalsozialismus, zum Beispiel im KZ Auschwitz.
Die Giftigkeit der Blausäure beruht auf der Blockade des Enzyms Cytochromoxidase, das u.a. dafür verantwortlich ist, dass Sauerstoff aus dem Hämoglobin freigesetzt werden kann [1].
Einige Lebensmittel wie Bittermandeln enthalten organische Verbindungen, die beim Verdauungsprozess Blausäure abspalten können. Der Konsum ungekochter Bittermandeln ist gefährlich, bei Kindern können schon fünf bis zehn Bittermandeln tödlich sein [4]. Auch in den Kernen von Kirschen und Pflaumen, vor allem aber in den Kernen von Pfirsich und Aprikosen kommt Blausäure in geringen Konzentrationen vor.
Säure-Base-Verhalten
Blausäure ist eine sehr schwache Säure, der pKS-Wert liegt zwischen 9,04 und 9,31 [2]. Wie schwach Blausäure ist, erkennt man daran, dass sie durch Kohlensäure aus ihren Salzen ausgetrieben werden kann [1] (starke Säuren verdrängen schwache Säuren aus ihren Salzen).
Die Salze der Blausäure heißen Cyanide. Die Cyanid-Ionen können leicht mit Eisen(II)sulfat-Lösung nachgewiesen werden, es bildet sich dann Berliner Blau, eine intensiv blau gefärbte Komplexverbindung, die der Blausäure auch ihren Namen gegeben hat.
Entsorgung von Cyanid-Lösungen
Lösungen, die Cyanid-Ionen enthalten, dürfen aus dem oben genannten Grund nicht mit Säuren behandelt werden, weil dann Blausäure bzw. Cyanwasserstoff freigesetzt wird. Will man eine solche Lösung fachgerecht entsorgen, werden diese zunächst auf einen alkalischen pH-Wert von 11 eingestellt und dann mit Kupfersulfat (Katalysator) versetzt. Im Abzug tropft man dann eine 30-prozentige H2O2-Lösung dazu (Wasserstoffperoxid). Dann lässt man das Gemisch zwei Stunden stehen. Bei diesem Prozess werden die Cyanid-Ionen zu Cyanat (OCN-) oxidiert, die dann langsam zu Ammoniak und Hydrogencarbonat hydrolysieren [6].
Einsatz in der Organischen Synthese
Ein bekanntes Beispiel für den Einsatz von Blausäure bzw. Cyanwasserstoff in der Organischen Synthese ist die Herstellung von Plexiglas, ein Thema, das gern im Oberstufen-Unterricht der Gymnasien behandelt wird (Unterrichtsreihe "Vom Erdöl zum Plexiglas").
Der Schritt 7 dieser Synthese ist die nucleophile Addition von HCN an Aceton. Das so gebildete Acetoncyanhydrin kann dann leicht in 2-Hydroxy-isobuttersäure umgewandelt werden.
Herstellung
BMA-Verfahren
Nach dem zweiten Weltkrieg wurde Blausäure hauptsächlich nach dem BMA-Verfahren hergestellt, das von der Firma Degussa Anfang der 50er Jahre weiterentwickelt worden ist. Dabei läuft im Grunde folgende Reaktion ab:
$CH_4 + NH_3 \to HCN + 3 \ H_2$
Die folgende Graphik aus der Wikipedia [3] zeigt das Verfahren schematisch:
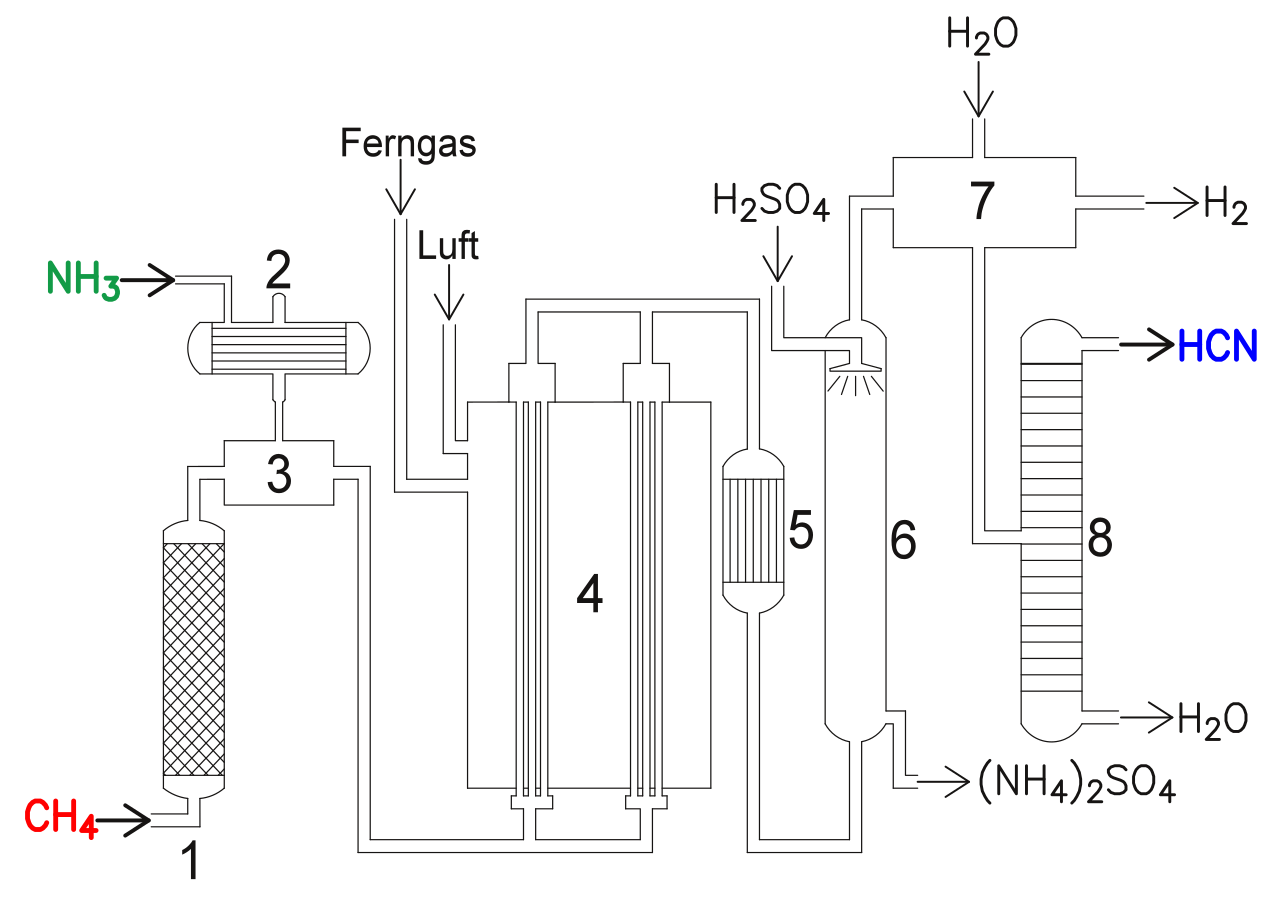
Die Blausäure-Synthese nach dem BMA-Verfahren
TSOL, CC BY-SA 4.0, via Wikimedia Commons
Links in dem Bild sehen wir die beiden Ausgangsstoffe Ammoniak und Methan. Das Methan muss zunächst gereinigt werden. Das geschieht mit Hilfe eines Platin-Katalysators in dem Reinigungsturm (1). Das Ammoniak wird im Ammoniakverdampfer (2) verdampft. In dem Mischer (3) werden die beiden Gase dann zusammengemischt, wobei ein leichter Ammoniak-Überschuss eingehalten wird, was die Rußbildung im Syntheseofen (4) vermindert.
Der Syntheseofen (4) ist quasi der Hauptteil der Anlage. Hier findet die eigentliche chemische Reaktion statt, und zwar bei 1.200 bis 1.300 ºC . Das Gasgemisch wird dabei durch dünne mit Platin beschichtete Röhren geleitet. Die Reaktion ist endotherm mit ΔH = 251 kJ/mol.
Das gasförmige Gemisch aus Cyanwasserstoff und den nicht verbrauchten Edukten wird nun abgekühlt (5). In dem Turm (6) wird das Gemisch dann mit Schwefelsäure gewaschen. Überschüssiges Ammoniak reagiert dann mit der Schwefelsäure zu Ammoniumsulfat (NH4)2SO4.
Neben Cyanwasserstoff HCN entsteht Wasserstoff H2 als zweites Produkt bei der Reaktion. Da sich HCN sehr gut in Wasser löst, erfolgt nun eine Behandlung mit Wasser (7). Der Cyanwasserstoff löst sich in dem Wasser, und der übrig gebliebene Wasserstoff wird abgeleitet.
Die wässrige Cyanwasserstoff-Lösung ( = Blausäure) wird nun destilliert, um gasförmigen Cyanwasserstoff in Reinform zu gewinnen.
Die Ausbeute an HCN ist nach diesem Verfahren mit 90% (bezogen auf Methan) relativ groß.
Andrussow-Verfahren
Während die Reaktion
$CH_4 + NH_3 \to HCN + 3 \ H_2$
die dem BMA-Verfahren zu Grunde liegt, endotherm ist, handelt es sich bei der Umsetzung, nach der das Andrussow-Verfahren abläuft, um eine recht exotherme Reaktion:
$CH_4 + NH_3 + 1,5 \ O_2\to HCN + 3 \ H_2O \ \ \ \Delta H = -469 kJ/mol$
Die Reaktion ist wesentlich komplexer als hier dargestellt und läuft in vielen radikalischen Einzelschritten ab, wie folgender Screenshot aus dem Wikipedia-Artikel zeigt [4]:
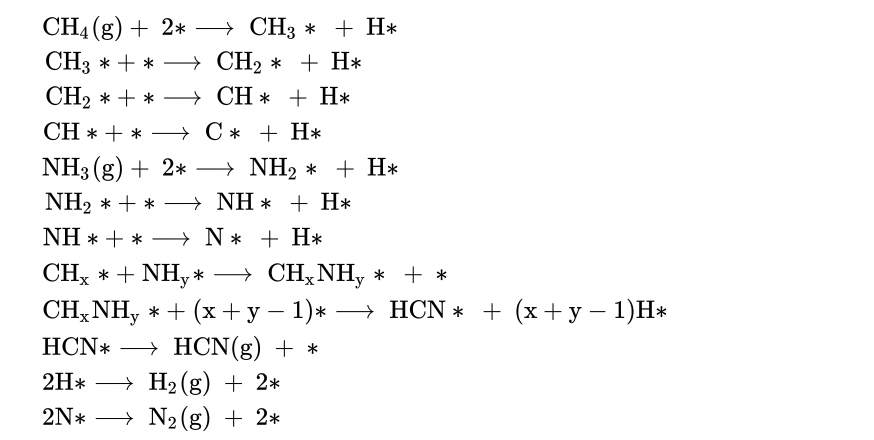
Teilreaktionen der HCN-Synthese nach dem Andrussow-Verfahren
Screenshot aus dem Wikipedia-Artikel
Trotz der Komplexität der Reaktion (die * stehen übrigens nicht für einsame Elektronen, sondern deuten an, dass die Teilchen an eine Platinoberfläche adsorbiert sind) ist dieses Verfahren das wichtigste industrielle Verfahren zur Synthese von Blausäure. Das BMA-Verfahren spielt dagegen nur eine untergeordnete Rolle [3].
Quellen:
- Römpp Chemie Lexikon, 9. Auflage 1989
- Wikipedia, Artikel "Blausäure"
- Wikipedia, Artikel "BMA-Verfahren".
- Wikipedia, Artikel "Andrussow-Verfahren"
- Wikipedia, Artikel "Bittermandel"
- Abituraufgabe "Blausäure - schwache Säure, starkes Gift" von 2021