Aldehyde sind organische Verbindungen, die eine Aldehyd-Gruppe -CHO enthalten. Hier ein paar Beispiele für Aldehyde:
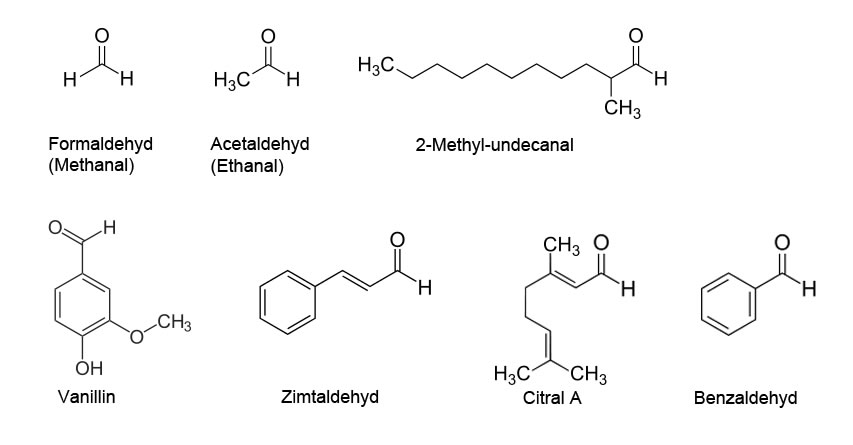
Formaldehyd, Acetaldehyd und 2-Methyl-undecanal gehören innerhalb der Aldehyde zu den Alkanalen, also zu den von einem Alkan abgeleiteten Aldehyden.
- Formaldehyd ist vom Methan abgeleitet und heißt daher auch Methanal. Methanal ist der einfachste Aldehyd überhaupt, er besteht quasi aus einer Carbonylgruppe, die mit zwei H-Atomen verbunden ist.
- Acetaldehyd oder Ethanal, vom Ethan abgeleitet, ist der zweiteinfachste Aldehyd. Im menschlichen Stoffwechsel entsteht Ethanal, wenn Ethanol abgebaut wird.
- 2-Methyl-undecanal ist vom 2-Methyl-undecan abgeleitet. Bekannt geworden ist diese Verbindung, weil sie ein wichtiger Bestandteil des berühmten Parfüms Chanel Nº 5 ist.
Die anderen vier Aldehyde der Abbildung gehören nicht zu den Alkanalen, sie sind komplexer aufgebaut und enthalten bis auf das Citral A einen Benzolring.
- Benzaldehyd ist der einfachste aromatische Aldehyd. Er kommt u.a. im Weißwein vor und bestimmt das Aroma des Weins. Davon abgesehen ist Benzaldehyd gesundheitsschädlich.
- Vanillin ist der wichtigste Aromastoff der Gewürzvanille.
- Zimtaldehyd ist der Hauptaromastoff der Rinde des Zimtbaums.
- Citral schließlich, unser letztes Beispiel für Aldehyde, ist ein Duftstoff, der u.a. in Tomaten vorkommt.
Physikalische Eigenschaften
Siede- und Schmelzpunkte
Aldehyd-Moleküle können untereinander keine H-Brücken bilden, weil das H-Atom der Aldehyd-Gruppe an einem C-Atom sitzt und nicht an einem O- oder N-Atom, die Aldehyd-Gruppe ist also kein H-Brücken-Donator.
Andererseits ist die C=O-Gruppe der Aldehyde stark polar, so dass Aldehyd-Moleküle Dipole sind, die sich gegenseitig anziehen.
Die Siede- und Schmelzpunkte der Aldehyde liegen damit im "mittleren" Bereich. Sie sind höher als die Werte entsprechender Alkane, wegen des Dipolcharakters der Aldehyd-Moleküle. Aber sie sind niedriger als die Werte vergleichbarer Alkohole oder Carbonsäuren, wegen der fehlenden Möglichkeit H-Brücken untereinander zu bilden.
Wasserlöslichkeit
Die CHO-Gruppe ist ein H-Brücken-Akzeptor, kann also beispielsweise mit H2O-Molekülen Wasserstoffbrücken bilden. Daher sind kurzkettige Aldehyde wie Methanal oder Ethanal ohne Probleme in Wasser löslich. Bei längerkettigen Aldehyden hat aber die Alkyl-Gruppe einen zunehmenden Einfluss auf die Löslichkeit, je länger die Alkyl-Gruppe, desto schlechter die Wasserlöslichkeit.
Chemische Eigenschaften
Die funktionelle Gruppe der Aldehyde ist stark polar. Das positiv polarisierte C-Atom kann leicht von Nucleophilen angegriffen werden, das negativ polarisierte O-Atom von Elektrophilen. Eine typische Reaktion der Aldehyde ist die Nucleophile Addition (Einzelheiten siehe dort).
Weiterführende Seiten
Auf diesen Seiten für die Stufe EF der gymnasialen Oberstufe finden Sie viele unterrichtsrelevante Fakten über die Stoffklasse der Aldehyde.
Für Studienanfänger(innen) und Schüler(innen), die sich für ein Chemie-Studium interessieren, gibt es weiterführende Seiten zum Thema "Aldehyde und Ketone" auf dieser Homepage, und zwar in der Abteilung "Studienvorbereitung Organik".