Als Allyl-Gruppe bezeichnet man eine C=C-Doppelbindung mit einem benachbarten primären oder sekundären C-Atom, das also zwei bzw. ein H-Atom besitzt.
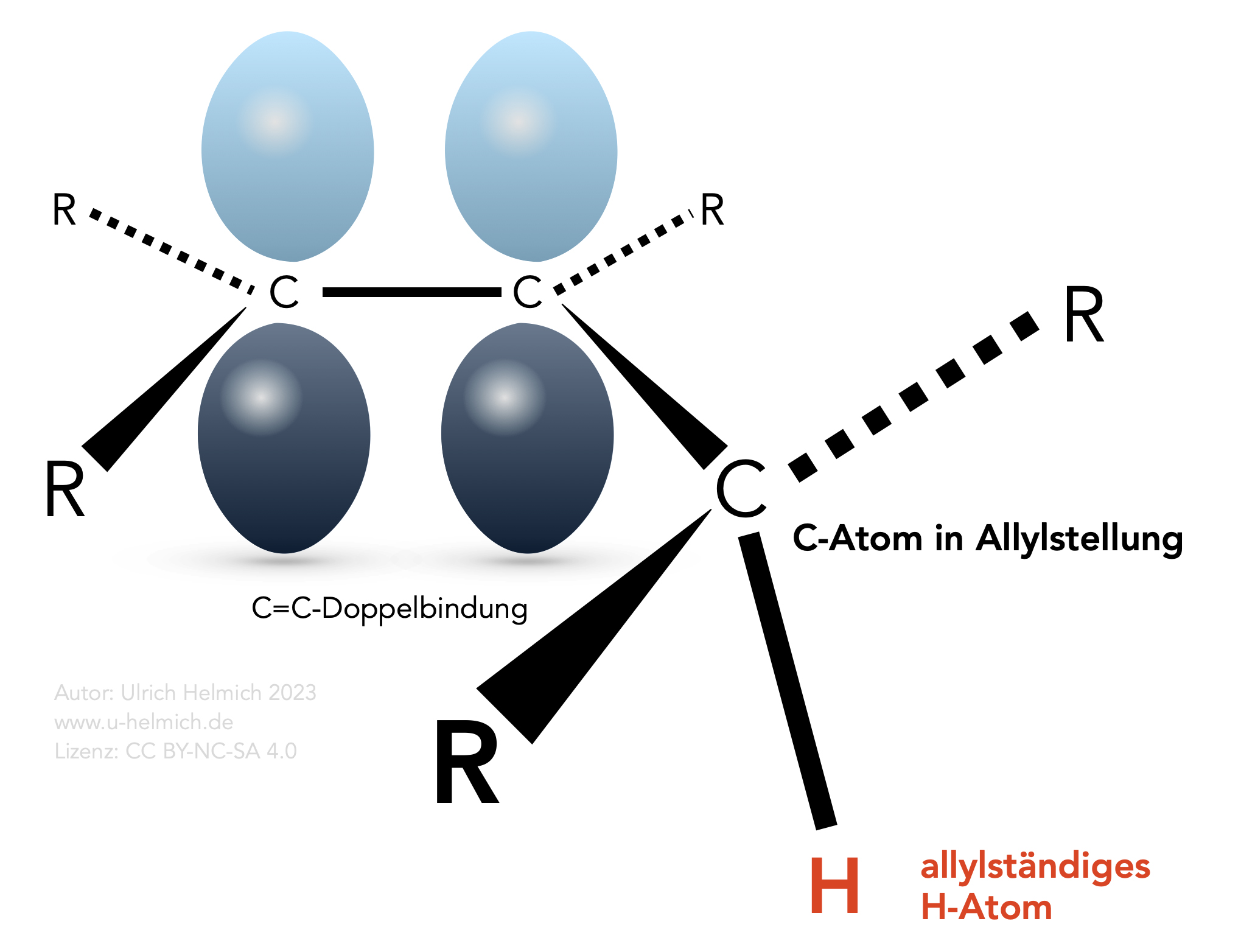
Die Allylstellung
Autor: Ulrich Helmich 01/2023, Lizenz: CC BY-NC-SA 4.0
Die C=C-Doppelbindung wurde nach dem Orbitalmodell dargestellt, man sieht hier die beiden pz-Orbitale mit ihren Orbitallappen, die Überlappung dieser beiden Orbitale wurde nicht mit eingezeichnet. Die H-Atome an dem benachbarten sp3-hybridisierten C-Atom werden als allylständige H-Atome bezeichnet, das sp3-hybridisierte C-Atom könnte man als allylständiges C-Atom bezeichnen.
Solche allylständigen C-Atome sind besonders reaktiv im Vergleich zu anderen C-Atomen. Im Vollhardt/Schore [1, S. 711ff] wird die Reaktivität dieses C-Atoms didaktisch sehr geschickt begründet, indem drei Befunde analysiert werden.
Befund 1
Ein allylständiges H-Atom kann leichter abstrahiert werden als ein tertiäres H-Atom. Die Bindungsdissoziationsenergie beträgt nur 364 kJ/mol (tertiäres H-Atom: 404 kJ/mol).
Befund 2
Die Bildung eines Carbenium-Ions (bei der SN1-Reaktion oder E1-Eliminierung) verläuft bei 3-Chlor-propen deutlich schneller als beispielsweise bei 1-Chlor-propan:

Der erste Schritt einer SN1-Reaktion bei 3-Chlor-propen und 1-Chlor-propan
Autor: Ulrich Helmich 04/2023, Lizenz: CC BY-NC-SA 4.0
Laut [1, S. 712] ist bei der Geschwindigkeit der Bildung eines Carbenium-Ions das allylständige C-Atom mit einem sekundären C-Atom vergleichbar.
Befund 3
Der dritte Befund, der die besondere Rolle des allylständigen H-Atoms hervorhebt, ist die Säurestärke. Propan hat einen pKS-Wert von ca. 50, während Propen einen pKS-Wert von um die 40 hat. Das allylständige H-Atom kann somit 1010 mal (10 Milliarden mal) leichter in Form eines Protons abgespalten werden als ein primäres oder sekundäres H-Atom des Propans.
Dieser Befund 3 ist übrigens nicht mit dem Befund 1 identisch, wie man vielleicht denken könnte, denn die Bindungsdissoziationsenergie bezieht sich auf eine homolytische Bindungsspaltung, während die Abgabe eines Protons eine heterolytische Bindungsspaltung ist.
Alle drei Befunde lassen sich relativ leicht erklären, wenn man sich die Zwischenprodukte oder Endprodukte der genannten Reaktionen anschaut. Bei der radikalischen Substitution eines allylständigen H-Atoms entsteht ein Allyl-Radikal, bei der nucleophilen Substitution ein Allyl-Kation, und bei der Abspaltung eines Protons ein Allyl-Anion. Schauen wir uns zunächst das Allyl-Radikal näher an.
Auf dieser Seite der Studienvorbereitung OC wird auf die radikalische Substitution bei Alkenen eingegangen.
Das Allyl-Radikal
Die allylständigen H-Atome können besonders leicht homolytisch abstrahiert werden, zum Beispiel durch ein Chlor- oder Brom-Radikal. Warum das so ist, zeigt das nächste Bild:
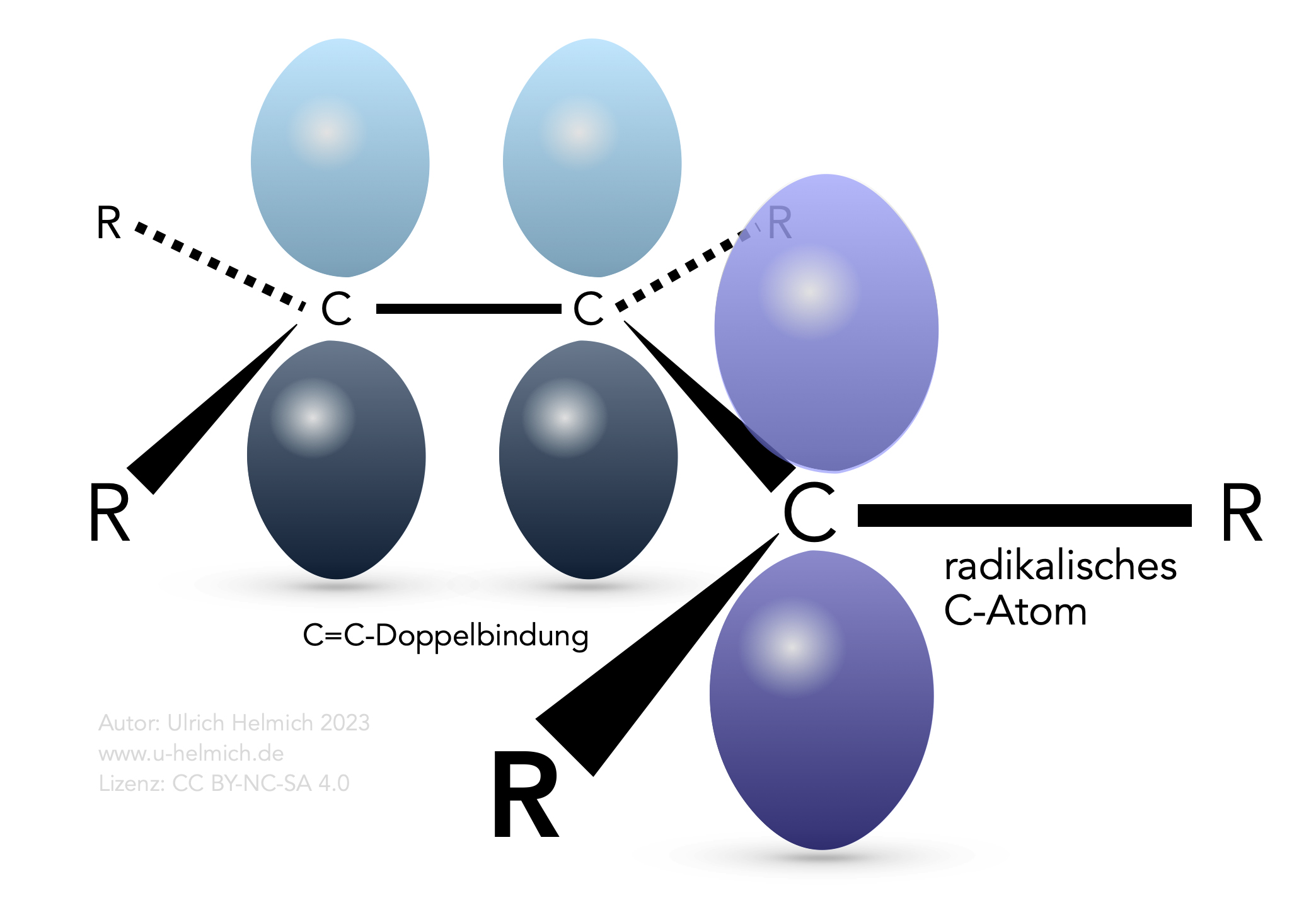
Ein H-Atom in Allylstellung wurde abstrahiert
Autor: Ulrich Helmich 01/2023, Lizenz: CC BY-NC-SA 4.0
Wird das allylständige H-Atom homolytisch abgespalten, resultiert ein Allyl-Radikal, so wie im Bild oben gezeichnet. Das allylständige C-Atom ist jetzt sp2-hybridisiert, und sein pz-Orbital kann mit den beiden pz-Orbitalen der Doppelbindung überlappen. Die drei Elektronen dieser drei pz-Orbitale sind dann delokalisiert, können sich also in dem gesamten Raum aufhalten, der von den drei pz-Orbitalen aufgespannt wird. Eine solche Delokalisierung von Elektronen führt allgemein zu einer höheren Stabilität der Struktur und wird oft mit dem +M-Effekt gleichgesetzt. Man kann schließlich mehrere Grenzstrukturen zeichnen, die die möglichen Verteilungen der drei Elektronen darstellen.
Allyl-Kation und Allyl-Anion
Die Elektronen der pz-Orbitale wurden ganz bewusst nicht mit eingezeichnet, denn die obige Abbildung kann auch gut eingesetzt werden, um die Struktur des Allyl-Kations und des Allyl-Anions zu beschreiben.
Beim Allyl-Kation ist das pz-Orbital des allylständigen C-Atoms leer, beim Allyl-Anion mit zwei Elektronen besetzt. Die zwei Elektronen des Kations bzw. die vier Elektronen des Anions sind aber ebenfalls delokalisiert, können sich also im gesamten Raum der drei pz-Orbitale aufhalten.
MO-Theorie des Allyl-Systems
Auf dieser Seite wird die MO-Theorie kurz erklärt.
Uns interessieren hier nur die π-Elektronen des Allyl-Systems. Überlappen mehrere pz-Orbitale, so existiert für jedes pz-Orbital ein π-Molekülorbital. Daher haben wir bei der normalen C=C-Doppelbindung mit ihren zwei pz-Orbitalen auch zwei π-MOs, ein bindendes π-MO und ein anti-bindendes π*-MO.

Die drei pi-Orbitale des Allyl-Systems
Autor: Ulrich Helmich 05/2023, Lizenz: Public domain
Dieses Bild zeigt die drei pi-Orbitale des Allyl-Systems. Unten sehen wir das energiearme bindende MO, ganz oben das energiereiche anti-bindende Molekülorbital. In der Mitte befindet sich das dritte MO, dessen Energie mit der eines freien pz-Orbitals identisch ist. Dieses MO wird als nicht-bindendes Molekülorbital bezeichnet.
Überlegungen zum "Verschwinden" des mittleren pz-Orbitals beim nicht-bindenden MO
Eine solche Abbildung wie die letzte findet man in fast allen Chemie-Hochschulbüchern, zum Beispiel im Vollhardt/Schore und auch überall im Internet. Beim nicht-bindenden MO wird das mittlere pz-Orbital nicht mit eingezeichnet - weder in den Büchern noch in den Abbildungen im Internet.
Betrachten wir dazu die folgende Abbildung:

Die drei pi-Orbitale des Allyl-Systems - eine Überlegung
Autor: Ulrich Helmich 05/2023, Lizenz: Public domain
Das nicht-bindendende MO besteht quasi aus zwei verschiedenen Anordnungen von pz-Orbitalen, die jeweils einen Anteil von 50% haben. Achten wir nun auf das mittlere pz-Orbital. Einmal befindet sich der Plus-Lappen oben und der Minus-Lappen unten, und bei der anderen Anordnung ist der Minus-Lappen oben und der Plus-Lappen unten. Die beiden pz-Anordnungen schalten sich also gegenseitig aus, und daher resultiert formal ein nicht vorhandenes pz-Orbital in der Mitte des Molekülorbitals.
Besetzung der drei pi-Orbitale

Die Besetzung der drei pi-Orbitale beim Allyl-Kation, -Radikal und -Anion.
Autor: Ulrich Helmich 05/2023, Lizenz: Public domain
Beim Allyl-Kation ist nur das bindende MO mit zwei Elektronen besetzt, die beiden anderen MOs sind leer.
Beim Allyl-Radikal ist das bindende MO mit zwei Elektronen besetzt, das nicht-bindende mit einem Elektron. Da die Energie das nicht-bindenden MOs der eines freien p-Orbitals entspricht, sollte das Allyl-Radikal energetisch nicht stabiler oder instabiler sein als das Allyl-Kation oder -Anion.
Beim Allyl-Anion ist das bindende MO mit zwei Elektronen besetzt, das nicht-bindende ebenfalls mit zwei Elektronen. Erst wenn eines dieser beiden Elektronen durch Absorption von UV-Licht oder anderer elektromagnetischer Strahlung in das anti-bindende MO befördert wird, wird die Bindung zwischen den C-Atomen geschwächt.
Quellen:
- K. P. C. VollhardT, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.