Die ZnBr2-Elektrolyse näher untersucht
Die Beschreibung des einfachen Grundversuchs finden Sie auf dieser Seite, außerdem drei Photos, die den Versuchsaufbau und die Beobachtungen zeigen.
Jetzt verändern wir den Grundversuch folgendermaßen:
Durchführung:
Wir führen wieder eine Zinkbromid-Elektrolyse durch. Diesmal schließen wir aber sowohl ein Voltmeter wie auch ein Amperemeter an, damit wir nicht nur die angelegte Spannung, sondern auch den tatsächlich fließenden Strom messen können.
Im Unterschied zu dem Grundversuch "Elektrolyse einer Zinkbromid-Lösung", beginnen wir den Versuch mit der Spannung 0 V. Das heißt, wir starten den Versuch erst mal ohne angelegte Spannung. Natürlich passiert hier noch nichts.
Nun erhöhen wir die Spannung ganz langsam und beobachten das Amperemeter.
Beobachtungen:
Zunächst können wir keinen Stromfluss beobachten. Erst dann, wenn eine bestimmte Spannung erreicht ist, beginnt das Amperemeter einen Wert größer als Null anzuzeigen. Erhöhen wir jetzt die Spannung weiter, steigt die Stromstärke linear mit der Spannung an.
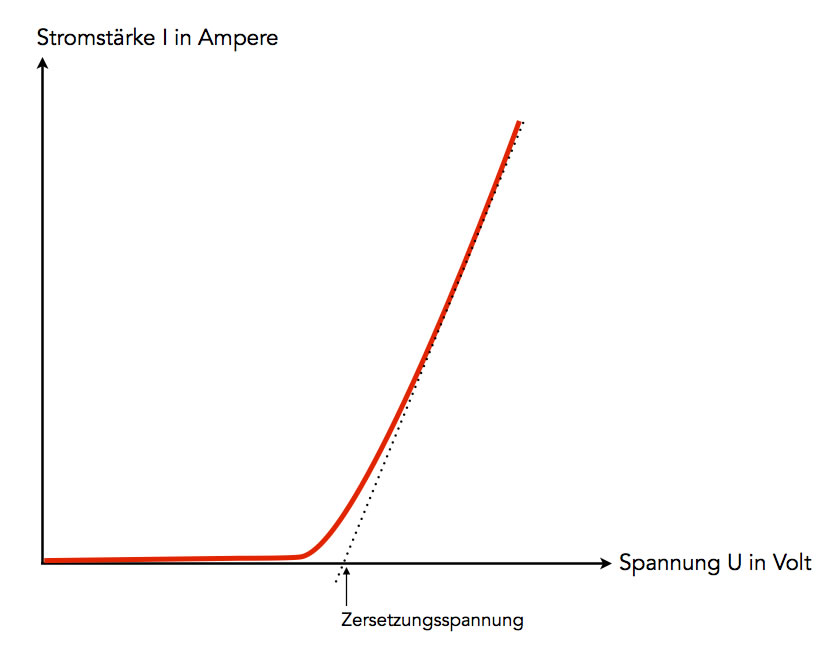
Ermittlung der Zersetzungsspannung
Autor: Ulrich Helmich 2020, Lizenz: Public domain
Wie kommt die Zersetzungsspannung zustande?
Das ist eine gute und berechtigte Frage. Die Zersetzungsspannung wird hauptsächlich durch zwei Faktoren bestimmt.
Faktor 1: Überwindung der durch die gebildeten Halbzellen erzeugten Spannung
Wenn man Zinkbromid elektrolysiert, kann man die Schüler(innen) mit folgendem Versuch zum Erstaunen bringen:
ZnBr2-Lösung wird für einige Zeit elektrolysiert, an dem Minuspol bildet sich mit der Zeit vielleicht ein Zinkbäumchen, an dem Pluspol kann man die Bildung roter Schlieren von Brom beobachten.
Nun zieht man die Kabel aus der Gleichstromquelle und schließt sie an ein Voltmeter (Gleichstrom) an.
Zum Erstaunen aller Zuschauer wird jetzt eine Spannung angezeigt, die sogar relativ hoch ist.
Die Erklärung für dieses Phänomen ist ganz einfach:
Durch die Elektrolyse entsteht eine Zinkschicht an dem Minuspol, und um dem Pluspol finden wir eine recht hohe Konzentration an in Wasser gelöstem Brom.
Im Grunde haben wir durch die Elektrolyse ein neues galvanisches Element erzeugt, das aus einer Zink-Halbzelle und einer Brom-Halbzelle besteht. Ein solches galvanisches Element liefert natürlich auch eine messbare Spannung. Mit Hilfe von komplizierten Berechnungen (Nernst-Gleichung) könnte man jetzt die genaue Höhe dieser Spannung ausrechnen, das wollen wir hier aber gar nicht machen. Es reicht, wenn wir verstanden haben, dass man durch die Elektrolyse einer Salzlösung zwei neue Halbzellen erzeugt, die eine Spannung liefern.
Sobald in dem Elektrolyse-Versuch eine Spannung an die beiden Elektroden angelegt wird, beginnt die Elektrolyse. Aber gleichzeitig bilden sich auch zwei Halbzellen, die wiederum eine Spannung liefern. Diese Spannung ist der angelegten Gleichspannung entgegengesetzt. Somit ist kein Stromfluss messbar. Erst wenn die angelegte Spannung größer ist als die Spannung, die durch die beiden Halbzellen erzeugt wird, kann man einen Stromfluss messen.
Die erste und wichtigste Komponente der Zersetzungsspannung ist die Spannung, die von dem durch die Elektrolyse erzeugten galvanischen Element geliefert wird.
Berechnung der Zersetzungsspannung
Wir wollen nun einmal die Zersetzungsspannung für die Elektrolyse einer Zinkbromid-Lösung berechnen. Damit die Rechnung auch ohne Nernstsche Gleichung auskommt, stellen wir eine ZnBr2-Lösung der Konzentration c(ZnBr2) = 1 mol/l her und führen den Versuch unter Standardbedingungen durch. Wir müssen also nur nachschauen, welche Standardredoxpotenziale die beiden Halbzellen haben. Das Standardredoxpotenzial der Zink-Halbzelle liegt bei -0,76 Volt [4], das der Brom-Halbzelle bei +1,07 Volt. Die Differenz hat also den Wert 1,83 Volt. Und genau dieser Wert ist die Zersetzungsspannung. Wir müssen also eine Gleichspannung von mindestens 1,83 Volt anlegen, wenn wir eine 1-molare Zinkbromid-Lösung elektrolysieren wollen.
Für die Elektrolyse einer Natriumchlorid-Lösung ist eine deutlich höhere Zersetzungsspannung notwendig. Das liegt vor allem an dem stark negativen Redoxpotenzial von Natrium (-2,71 Volt) und dem etwas positiveren Redoxpotenzial von Chlor (+1,36 Volt). Die Zersetzungsspannung liegt also bei 4,07 Volt.
Faktor 2: Überspannung
Allerdings halten sich nicht alle Elektrolysen an diese theoretischen Berechnungen. Oft ist die gemessene Zersetzungsspannung höher als die berechnete. Ursache für diese Überspannung - so bezeichnet man die Differenz zwischen berechneter Zersetzungsspannung und tatsächlich gemessener Zersetzungsspannung - ist meistens von dem Elektrodenmaterial und der Oberflächenbeschaffenheit der Elektroden abhängig, aber auch von dem Elektrolyten selbst. Und an den Oberflächen der Elektroden können weitere chemische Reaktionen stattfinden, welche die erforderliche Spannung noch weiter erhöhen. Das ist vor allem dann der Fall, wenn bei der Elektrolyse Gase freigesetzt werden. Bei der Elektrolyse einer wässrigen Salzlösung ist stets damit zu rechnen, dass auch das Wasser elektrolytisch zersetzt wird, was natürlich wieder "Spannung kostet".
In dem YouTube-Video "Flint/Zschäckel: Elektrochemie einmal anders" ist ein schöner Versuch zu sehen, mit dem man mit einfachen Mitteln die Überspannungen verschiedener Elektroden gleichzeitig quantitativ messen kann.
Seitenanfang -
Weiter mit dem Faraday-Gesetz ...
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Lexikon der Physik, Spektrum-Verlag, Artikel "Zersetzungsspannung"
- Wikipedia, Artikel "Zersetzungsspannung"
- Wikipedia, Artikel "Elektrochemische Spannungsreihe"