Unter einer Decarboxylierung versteht man in der organischen Chemie die Substitution einer COOH-Gruppe durch ein H-Atom unter Abspaltung von CO2.
Die Oxidationszahl des alpha-C-Atoms ändert sich dadurch leicht von -II zu -III, was der Reduktion um eine Stufe entspricht:
Änderung der Oxidationszahlen durch eine Decarboxylierung
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Die Oxidationszahl des Carboxy-C-Atoms steigt dagegen von +III auf +IV.
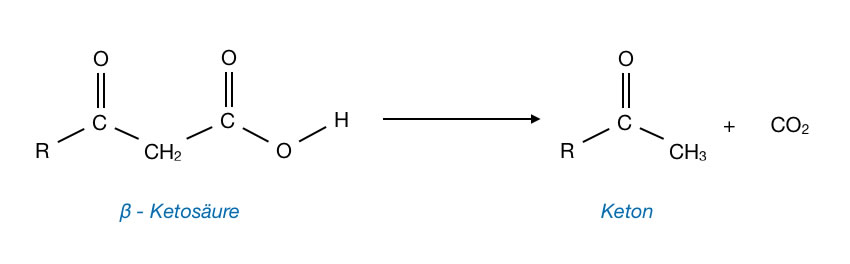
Decarboxylierungen kommen vor allem bei Ketosäuren vor.
Die zusätzliche Ketogruppe in β-Stellung zieht Elektronendichte von dem α-C-Atom ab, so dass dieses leichter von Nucleophilen angegriffen werden kann. Hydrid-Ionen sind solche Nucleophile, und nun kann man sich leicht vorstellen, dass bei einer solchen Decarboxylierung einfach die COOH-Gruppe durch ein Hydrid-Ion nucleophil substituiert wird. Leider ist diese Vorstellung dann doch zu simpel, Decarboxylierungen laufen normalerweise etwas komplexer ab und in mehreren Reaktionsschritten.
Normale Carbonsäuren können nur bei recht hohen Temperaturen decarboxyliert werden, während Ketosäuren oder Dicarbonsäuren schon bei relativ niedrigen Temperaturen zwischen 100 und 150 ºC decarboxyliert werden.
Zum Mechanismus
Zum Mechanismus der Decarboxylierung findet man nicht viel in der Fachliteratur oder im Internet. Im Buddrus/Schmidt findet sich eine Abbildung, auf die wir hier kurz eingehen wollen.

Decarboxylierung von Acetessigsäure
Autor: Ulrich Helmich, nach einer Abbildung im Buddrus/Schmidt, Lizenz: Public domain
Die gebogenen roten Pfeile deuten das Umklappen von Bindungselektronenpaaren an.
Decarboxylierung durch Elektrolyse
Ein bekanntes und in der Industrie genutztes Verfahren zur Decarboxylierung von Carbonsäure-Salzen ist die Kolbe-Elektrolyse.

Die Kolbe-Elektrolyse eines Carbonsäure-Salzes
Autor: Ulrich Helmich 06/2024, Lizenz: CC BY-NC-SA 4.0
Am Pluspol (der Anode) wird dem Carboxylat-Anion ein Elektron entzogen, es entsteht dann ein Carboxylat-Radikal mit einem einsamen Elektron an dem O-Atom.
Im zweiten Schritt klappen wieder ein paar Elektronen um, diesmal aber keine Elektronenpaare, sondern einzelne Bindungselektronen. Das ist durch die roten Pfeile mit der "halben" Spitze angedeutet (was beim Zeichnen sehr viel Arbeit machte, da Apple Pages leider keine solchen Pfeilspitzen anbietet).
Unter Abspaltung von CO2 entstehen dann Alkyl-Radikale, von denen sich je zwei zu einem Alkan-Molekül vereinigen.
Historisches
Diese Art der elektrochemischen Reaktion wurde übrigens schon 1834 von Michael Faraday entdeckt. Er hatte beobachtet, dass bei der Elektrolyse von Kaliumacetat ein Kohlenwasserstoff entsteht. Herrmann Kolbe untersuchte diese Reaktionen dann etwas genauer und erkannte, dass bei der Elektrolyse von Acetaten das Alkan Ethan entsteht. Damit gilt Kolbe als eigentlicher Entdecker und Namensgeber dieser Reaktion.
Anwendungen
Fettsäuren mit 16 oder 18 C-Atomen wie Palmitin- oder Stearinsäure können sehr leicht aus Fetten gewonnen werden. Durch die Kolbe-Elektrolyse können aus solchen Fettsäuren sehr leicht sehr langkettige Alkane hergestellt werden. Aus Natriumpalmitat (C15H31-COONa) kann man beispielsweise das Alkan Triacontan (C30H62) synthetisieren [2].
Quellen:
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
Seitenanfang -
Weiter mit ...