Die Elektronentransportkette der photosynthetischen Lichtreaktion besteht aus zwei Photosystemen, die nach der Reihenfolge ihrer Entdeckung als I und II bezeichnet werden. Beide Photosysteme sind große Proteinkomplexe, die die Membran der Thylakoide der Chloroplasten durchziehen.
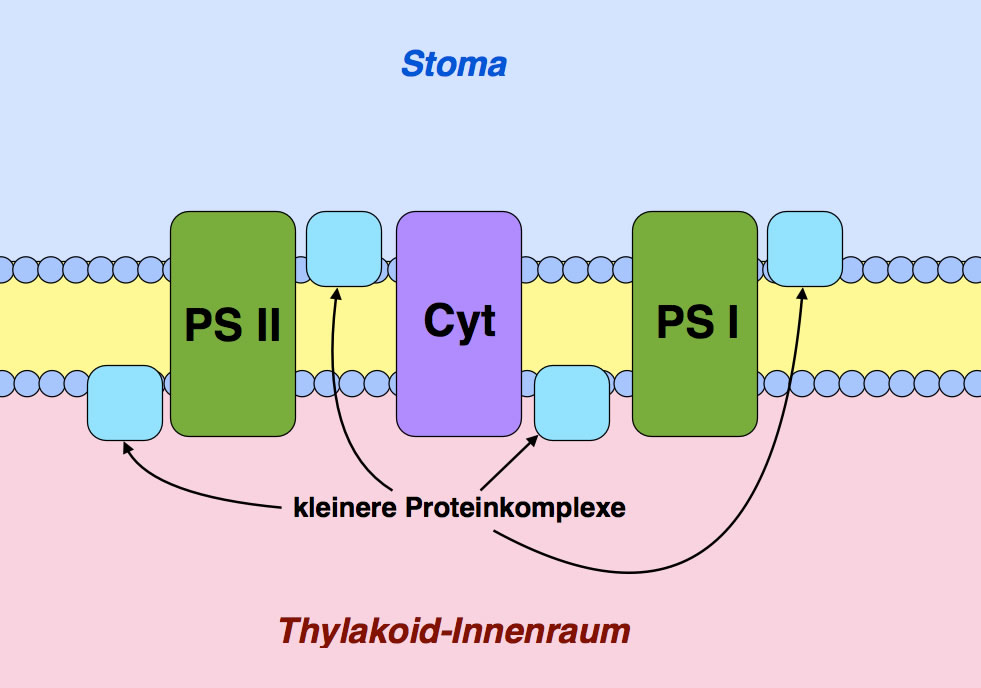
Stark vereinfachtes Schema der Thylakoid-Membran mit den eingelagerten Pigmenten
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Die Lichtreaktion beginnt am Photosystem II, dessen Aufgabe es ist, Wasser-Moleküle in Protonen, Elektronen und Sauerstoff zu spalten.
Struktur
Das PS II besteht aus zwei Proteinen, die als D1 und D2 bezeichnet werden. Jedes dieser beiden Proteine besteht aus ca. 8 bis 10 Untereinheiten. Die Photosynthesepigmente sind in diese Untereinheiten eingebettet. Die folgende Abbildung stellt den Aufbau des Photosystem II schematisch dar:
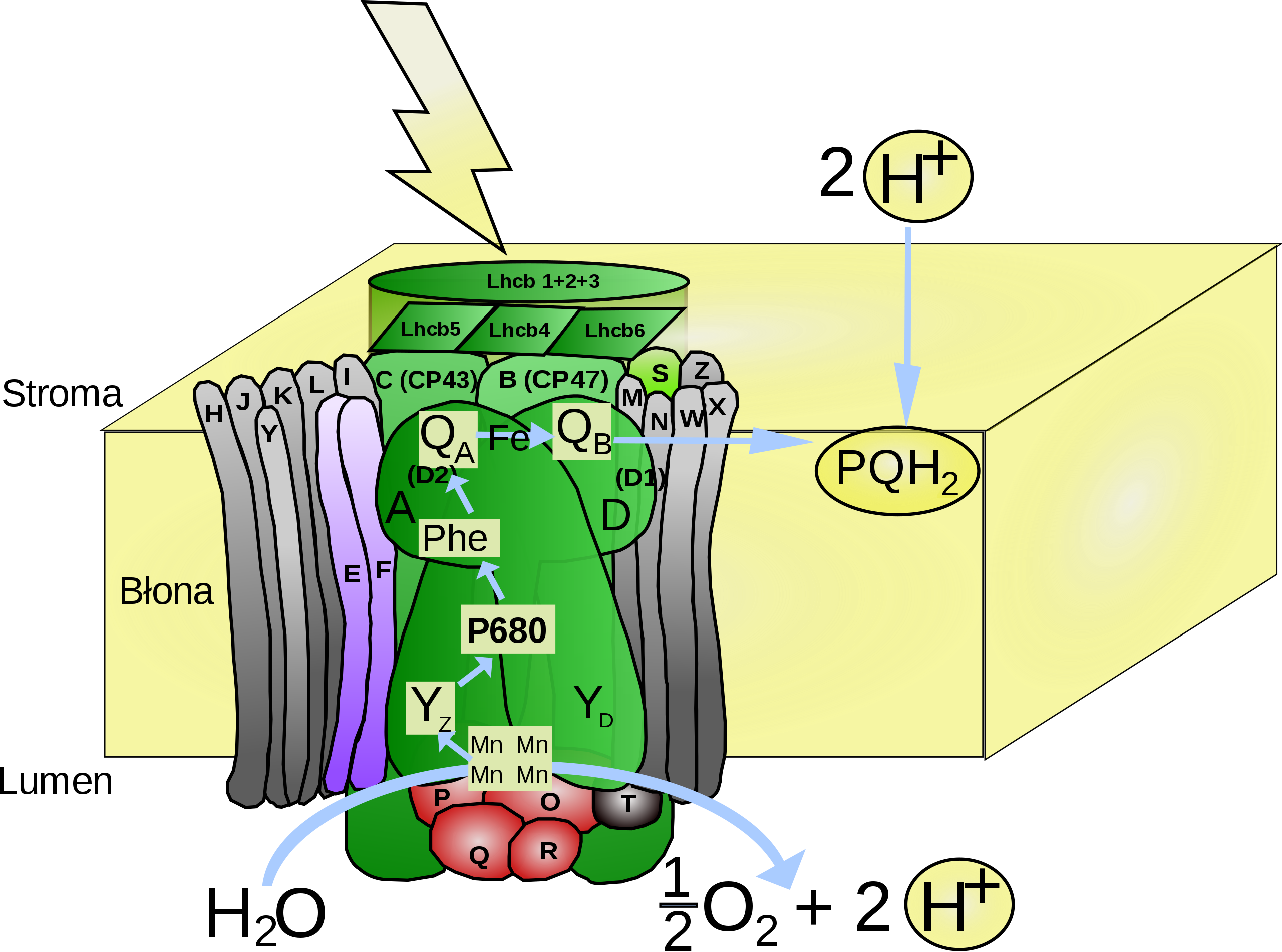
Das Photosystem II. Blaue Pfeile: Weg der zwei Elektronen.
Autor :Pisum, Lizenz: Public Domain.
Laut [1] enthält das PS II 36 Chlorophyll a-Einheiten, zwei Phaeophytin- und zwei Häm-Gruppen sowie mehrere Carotine als Schutzfaktoren, laut [2] sollen es 11 Carotin-Moleküle sein. Die meisten der Farbstoffe sind "tief im Innern vergraben und eng mit dem Protein verbunden" [1].
In einem der beiden Protein-Monomere, D1 oder D2, liegt das Reaktionzentrum von Photosystem II. Es besteht aus zwei speziellen Chlorophyll-Molekülen, deren Absorptionsmaximum bei einer Wellenlänge von 680 nm liegt und die daher zusammen als P680 bezeichnet werden.
Funktionsweise
Die Antennenpigmente des Lichtsammelkomplexes leiten die aufgenommene Lichtenergie zum P680-Reaktionszentrum weiter.
Auf dieser Seite habe ich ausführlich beschrieben, wie ein Lichtsammelkomplex aufgebaut ist und auch wie die absorbierte Lichtenergie von einem beliebigen Antennenmolekül auf das Reaktionszentrum übertragen wird.
Das Reaktionszentrum überträgt die Energie in Form von zwei Elektronen auf ein Pheophytin- und ein Plastochinon-Molekül (Phe bzw. QA). Von dort werden die Elektronen dann weiter auf ein zweites Plastochinon-Molekül (QB) übertragen, welches daraufhin durch die beiden Elektronen und durch Aufnahme von zwei Protonen zu QBH2 (Plastochinol) reduziert wird (in der Abbildung als PQH2 bezeichnet).
Achten Sie darauf, dass im Lumen der Thylakoide bei der Photolyse des Wassers zwei Protonen freigesetzt werden, während im Stroma des Chloroplasten zwei Protonen durch die Reduktion des Plastochinons zu Plastochinol verbraucht werden. Diese beiden Vorgänge tragen zur Erzeugung des Protonengradienten quer über die Thylakoidmembran bei.
Nachdem wir nun besprochen haben, wie das Reaktionszentrum erregt wird und seine Elektronen weitergibt, müssen wir uns nun der Frage zuwenden, wo sich das P680 die beiden gespendeten Elektronen wieder herholt, um seinen ursprünglichen Zustand wieder herzustellen.
Jetzt kommt der Elektronendonator H2O ins Spiel. Das Redoxpotenzial von P680 ist mit +1270 mV [1] derart positiv, dass es vom Wasser (Redoxpotenzial +820 mV) locker Elektronen übernehmen kann. Wenn dem Wasser-Molekül durch P680 zwei Elektronen entzogen werden (siehe auch Photolyse des Wassers), bleiben nur noch zwei Protonen und ein Sauerstoff-Atom vom H2O-Molekül über:
$2 \ H_{2}O + 2 \ Q + 4 \ H^{+}_{Stroma} \to O_{2} + 2 \ QH_{2} + 4 \ H^{+}_{Lumen}$
Diese Gleichung wird normalerweise mit zwei Wasser-Molekülen formuliert, weil die Photolyse des Wassers in vier Schritten erfolgt, wobei bei jedem Schritt ein Photon absorbiert wird. Aus zwei Wasser-Molekülen werden also vier Elektronen und vier Protonen freigesetzt, die dann aber das Plastochinon Q zu QH2 reduzieren. Da der Transport der vier Elektronen "bergab" stattfindet (siehe Redoxpotenziale von Wasser und P680), verläuft dieser Elektronentransport exotherm, und die dabei freigesetzte Energie kann zur Erzeugung des Protonengradienten quer über die Thylakoidmembran benutzt werden, was ja auch in der obigen Gleichung schon angedeutet wird.
Der Mangan-Komplex
Eine zentrale Rolle bei der Photolyse des Wassers spielt der Komplex aus vier Mangan-Atomen, fünf Sauerstoff-Atomen und einem Calcium-Atom [5].
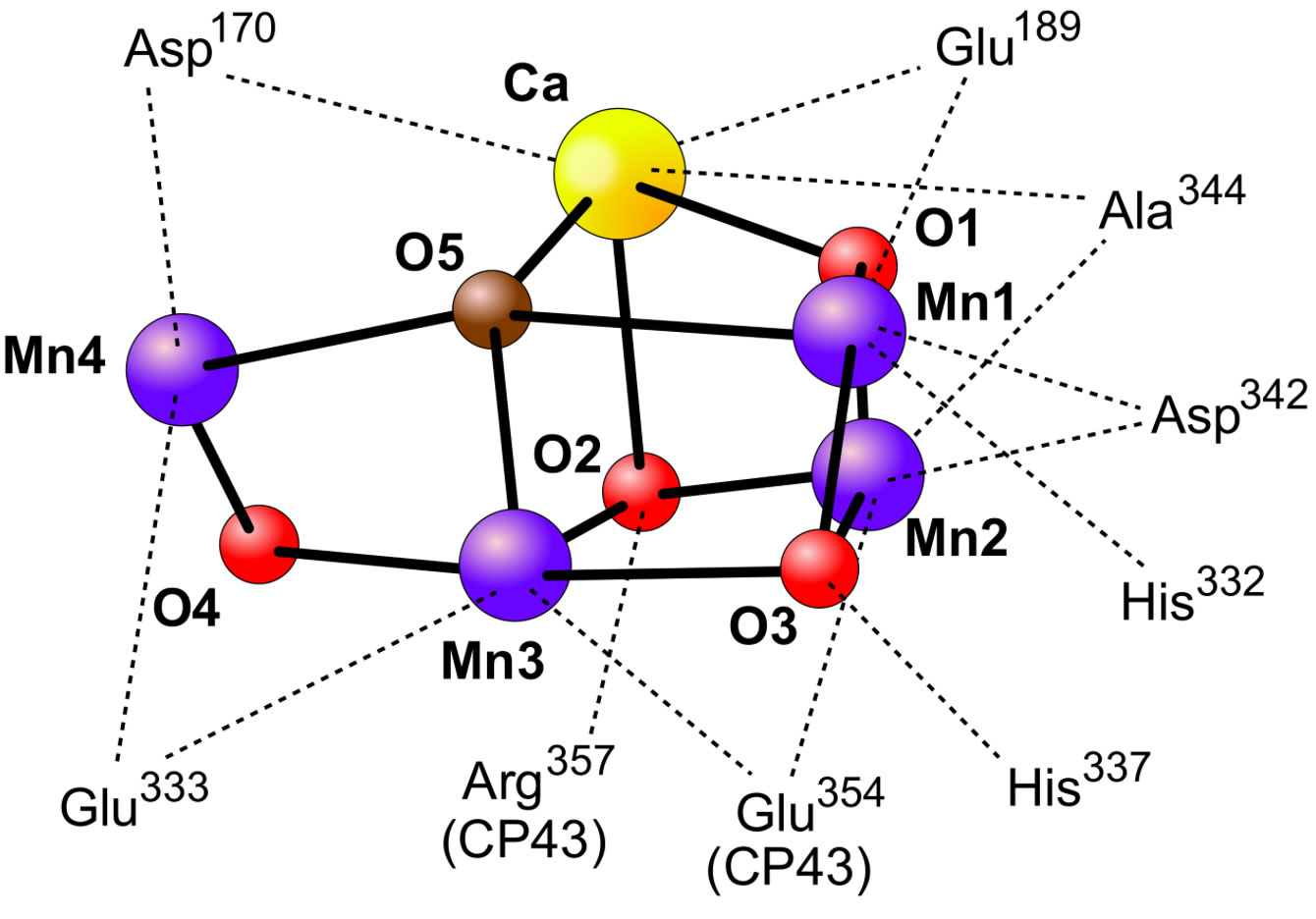
So ungefähr stellt man sich den Mangan-Komplex vor
Autor:Yikrazuul, Lizenz: Creative Commons Attribution-Share Alike 3.0 Unported license.
Mangan ist ein Nebengruppenmetall (steht im PSE zwischen Chrom und Eisen) und kann mehrere Oxidationsstufen annehmen. Jedes Mn3+-Ion kann daher leicht ein Elektron an das positive P680-Kation abgeben (also an das P680, das seine Elektronen bereits weitergeleitet hat). Da vier Mangan-Ionen vorhanden sind, können auch vier Elektronen zum P680 gelangen. Diese vier Elektronen holen sich die Mn4+-Ionen dann von den beiden Wasser-Molekülen zurück. Auch das ist wieder ein Bergab-Transport, denn das Redoxpotenzial des Mangan-Komplexes ist positiver als das Redoxpotenzial des Wassers, aber nicht ganz so positiv wie das Redoxpotenzial des P680.
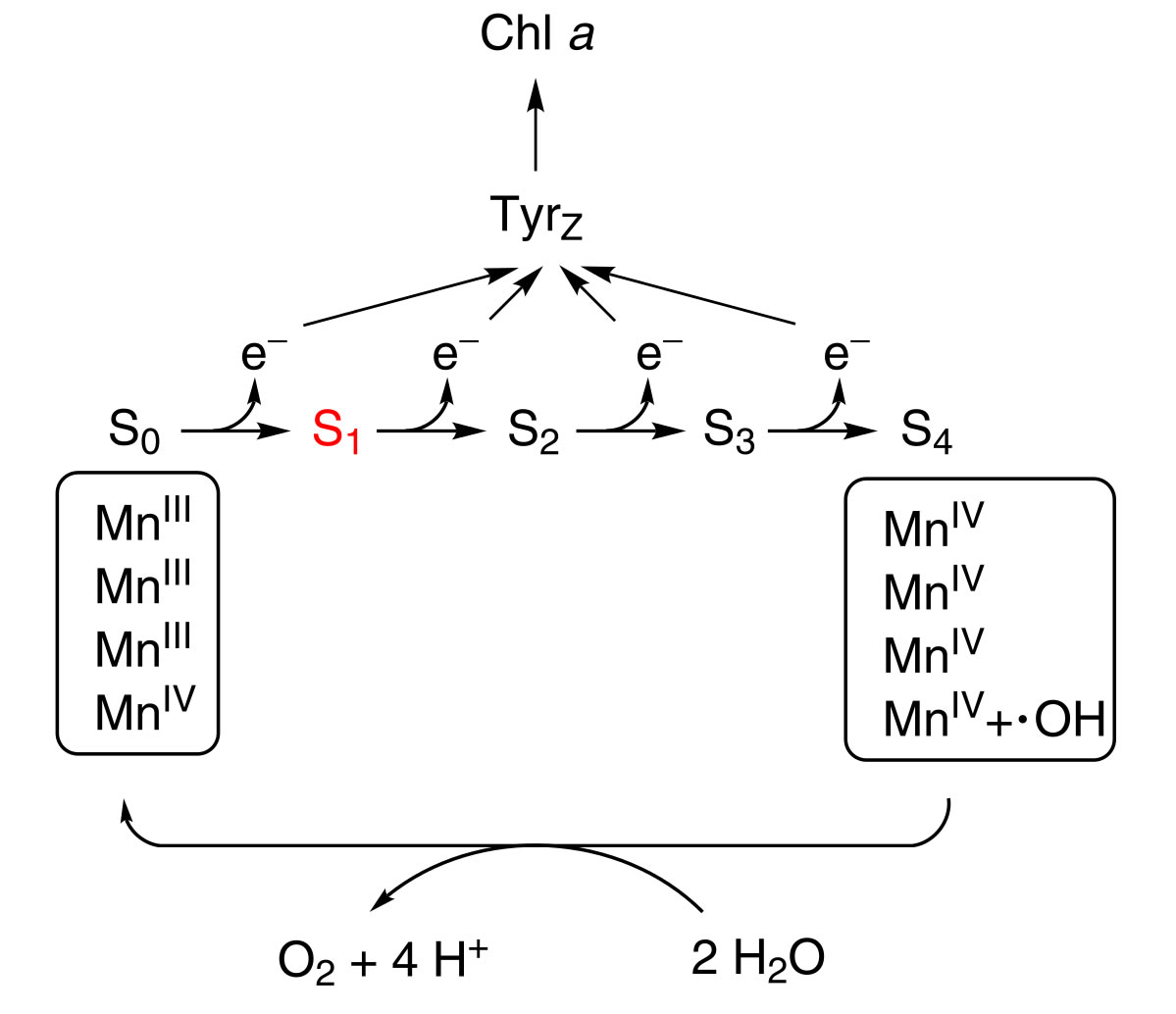
Beschreibung
Autor: Yikrazuul, Lizenz: Public domain
Auf diesem Bild aus der englischsprachigen Wikipedia ("Oxygen-evolving complex") sieht man die Vorgänge bei der Photolyse des Wassers in Einzelschritte zerlegt. Der Mangan-Komplex enthält im Stadium 4 (S4) vier Mn4+-Ionen und ein Hydroxyl-Radikal *OH. Dieser Komplex nimmt nun die vier Elektronen auf. Drei der Mn4+-Ionen werden jetzt zu Mn3+-Ionen reduziert, und das *OH-Radikal nimmt ein Elektron auf und wird zum OH--Ion, was im Bild aber nicht zu sehen ist.
➥Lichtsammelkomplex
➥P680-Aktivierung
Auf diesen drei Lexikon-Seiten finden Sie noch weitere Einzelheiten zu den hier dargestellten Themen, falls Ihnen die Ausführungen auf dieser Seite noch nicht reichen.
Der Wikipedia-Artikel zum Photosystem II ist auch sehr lesenswert. Er enthält viele Informationen und Fakten, die auch in aktuellen Lehrbüchern wie dem Alberts oder dem Lehninger nachzulesen sind.
Quellen:
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Wikipedia, Artikel "Photosystem II"
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Engl. Wikipedia, Artikel "Oxygen-evolving complex"