Vorkommen, Bedeutung
Die Hexokinase ist ein Schlüsselenzym der Glycolyse, also des ersten Schrittes der aeroben und auch anaeroben Dissimilation. Der Reaktionsschritt, der von diesem Enzym katalysiert wird, ist die Übertragung einer Phosphatgruppe von einem ATP-Molekül auf das C6-Atom eines Glucose-Moleküls.
Aber auch in der Synthese von Glycogen in der Leber ist die Anwesenheit von Hexokinase erforderlich. Das Glycogen wird aus Glucose-1-Phosphat gebildet, das seinerseits aus Glucose-6-Phosphat entsteht. Und für die Bildung von Glucose-6-Phosphat wird Hexokinase benötigt.
Der Schritt 1 der Glycolyse ist auf dieser Seite näher beschrieben.
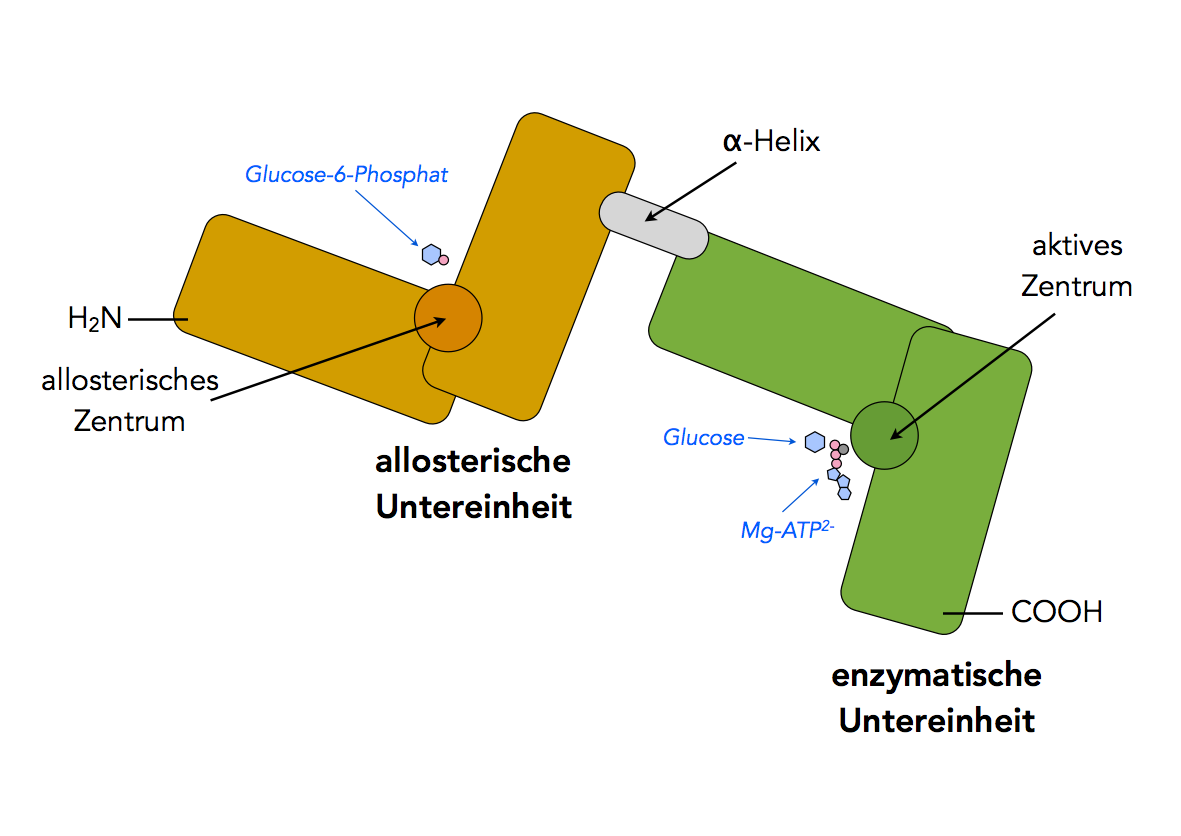
Hexokinase
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Auf diesem Bild (Vorlage war eine Animation aus dem YouTube-Film "Hexokinase: A VR Experience") sehen wir die beiden Untereinheiten eines Hexokinase-Moleküls. Die beiden Untereinheiten sind ähnlich aufgebaut, man vermutet, dass sie durch Genduplikation aus einer Vorläuferform entstanden sind. Die Hexokinasen der Prokaryoten bestehen nämlich aus nur einer Untereinheit. Beide Untereinheiten der Eukaryoten-Hexokinasen sind durch eine einfache alpha-Helix miteinander verbunden.
Jede der beiden Untereinheiten besteht aus zwei "Lappen". Bei Eukaryoten ist aber nur eine der beiden Untereinheiten enzymatisch aktiv, nämlich die am COOH-Ende des Proteins (im Bild grün gezeichnet). Die andere Untereinheite am H2N-Ende dient zur allosterischen Regulation des Enzyms: Das Reaktionsprodukt der Umsetzung, Glucose-6-Phosphat, setzt sich an die allosterische Untereinheit. Dadurch wird die Struktur der enzymatischen Untereinheit verändert, wodurch das Enzym allosterisch gehemmt wird [4].
Bei der Aufnahme von Glucose in das aktive Zentrum der enzymatischen Untereinheit bewegen sich die beiden Lappen dieser Untereinheit aufeinander zu. Experimentelle Untersuchungen zeigen dabei eine Drehung des einen Teils um 12 Grad bzw. 0,8 nm [3].
Dies ist ein schönes Beispiel für den induced-fit-Mechanismus von Enzymen. Das aktive Zentrum wird erst durch die Aufnahme des Substrats an die Form des Substrats bzw. der Substrate angepasst - die Hexokinase hat ja zwei Substrate, nämlich die Glucose und den Mg-ATP2--Komplex.
Durch die Schließung des Spaltes in der enzymatischen Untereinheit wird das Glucose-Molekül fast ganz eingeschlossen, lediglich die OH-Gruppe am C6-Atom bleibt frei zugänglich. Das ist auch erforderlich, weil auf das O-Atom der herausstehenden CH2OH-Gruppe eine Phosphatgruppe übertragen werden soll. Zwei der vier negativen Ladungen des ATP-Moleküls werden durch ein Magnesium-Ion kompensiert, was die Reaktion stark erleichtert.
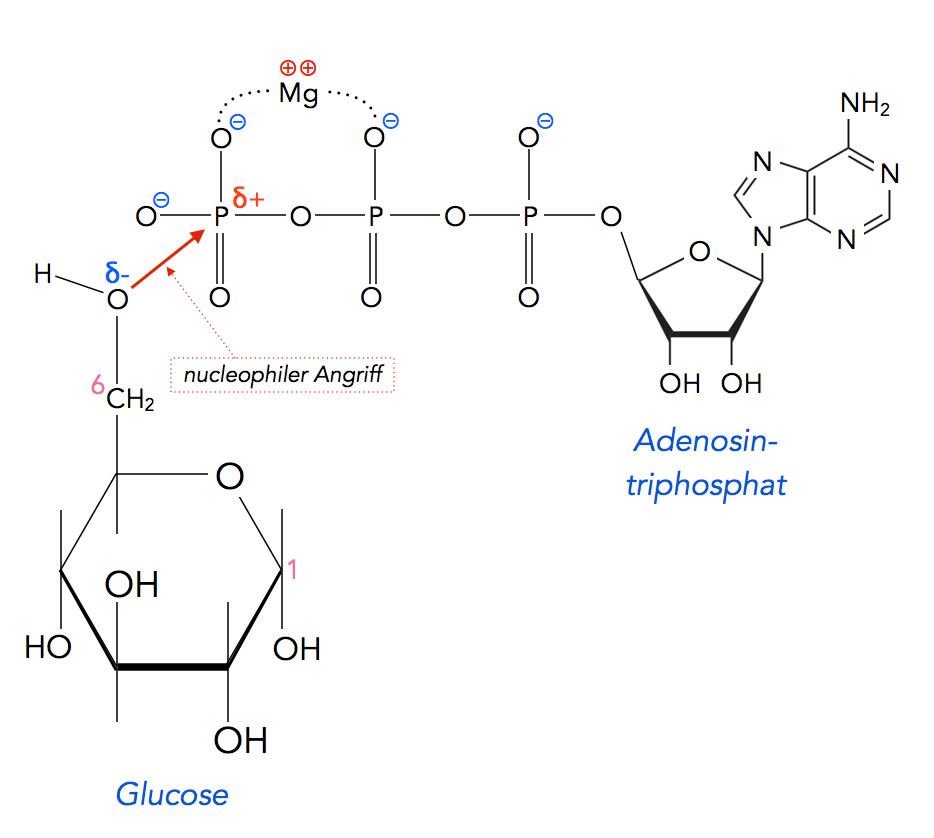
Beschreibung
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das H-Atom der CH2OH-Gruppe des Glucose-Moleküls wird von einer basischen Aminosäure der Hexokinase abgespalten; dort entsteht dann aus einer NH2-Gruppe eine NH3+-Gruppe. Das jetzt negative O-Atom der CH2OH-Gruppe (jetzt also eine CH2O--Gruppe) greift das positiv polarisierte Phosphoratom der endständigen Phosphatgruppe des ATPs nucleophil an. Die Bindung zwischen dem Phosphor-Atom und dem nächsten Sauerstoff-Atom im ATP wird dabei gespalten, zurück bleibt ADP und die phosphorylierte Glucose.
Wie bei vielen nucleophilen Reaktionen wird die Umsetzung behindert, wenn Wasser-Moleküle "im Wege" sind. H2O-Moleküle bilden Hydrathüllen um negative oder positive Ionen. Die negative Ladung am Glucose-O-Atom würde durch eine solche Hydrathülle abgeschirmt, und die Reaktion mit ATP würde wesentlich langsamer verlaufen. Durch das Einhüllen der Glucose von dem Enzym wird diese "Störmanöver" der Wasser-Moleküle aber verhindert, die Reaktion kann mit unverminderter Geschwindigkeit ablaufen.
Ein zweiter Vorteil der Umhüllung der Glucose durch das Enzym ist die Vermeidung von einer Konkurrenzreaktion: Wasser-Moleküle könnten das ATP zu ADP und Pi hydrolysieren [3], und dann hätte sich die Reaktion des ATP mit der Glucose erledigt.
Die beiden Substrate, Glucose und ATP, werden durch zahlreiche Wasserstoffbrücken-Bindungen in dem aktiven Zentrum festgehalten, wie man auf dem folgenden Bild gut sehen kann, das übrigens von einer Abbildung im neuen Markle, Biologie Oberstufe von 2023 inspiriert wurde:
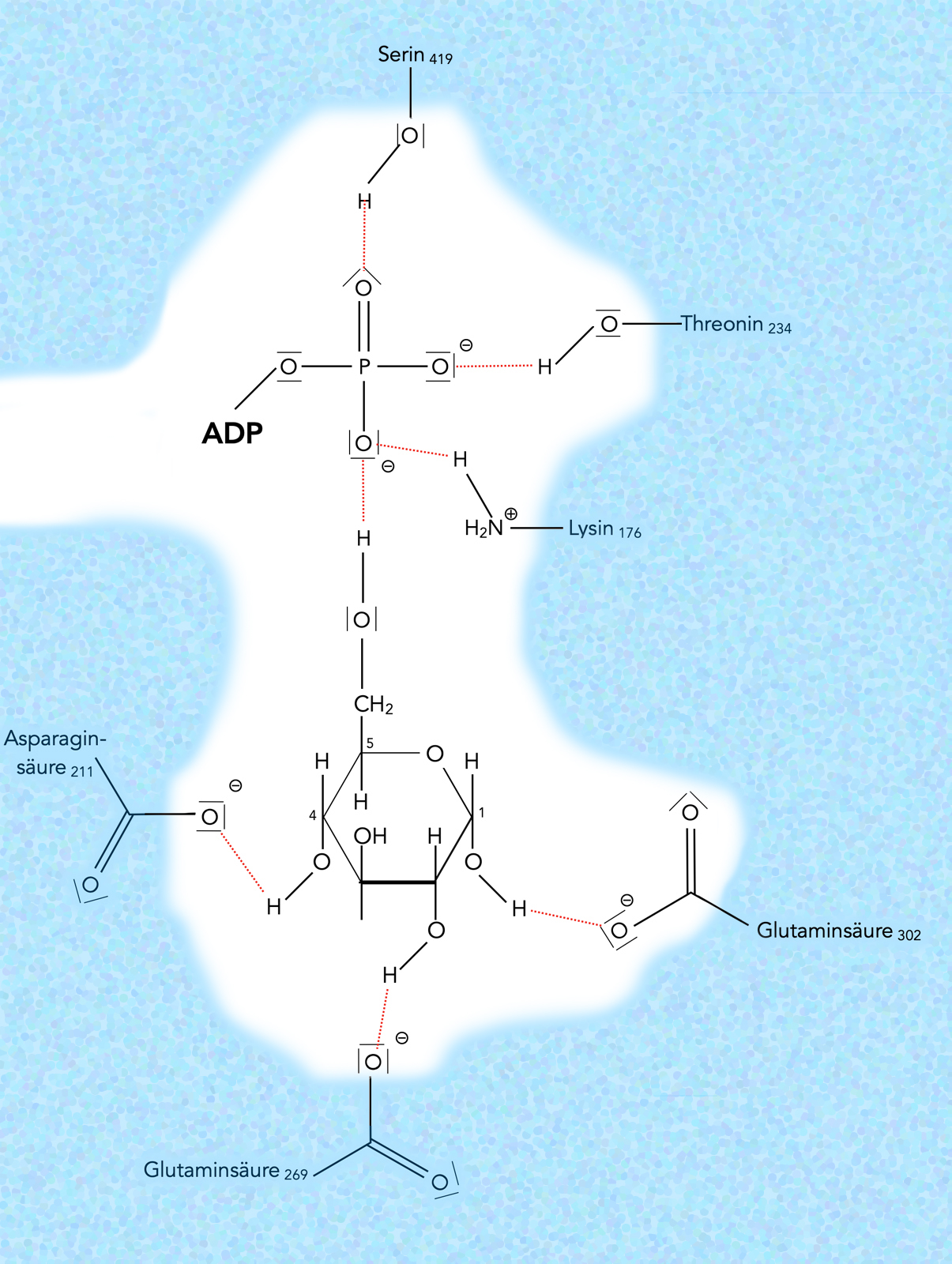
Das aktive Zentrum der Hexokinase
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
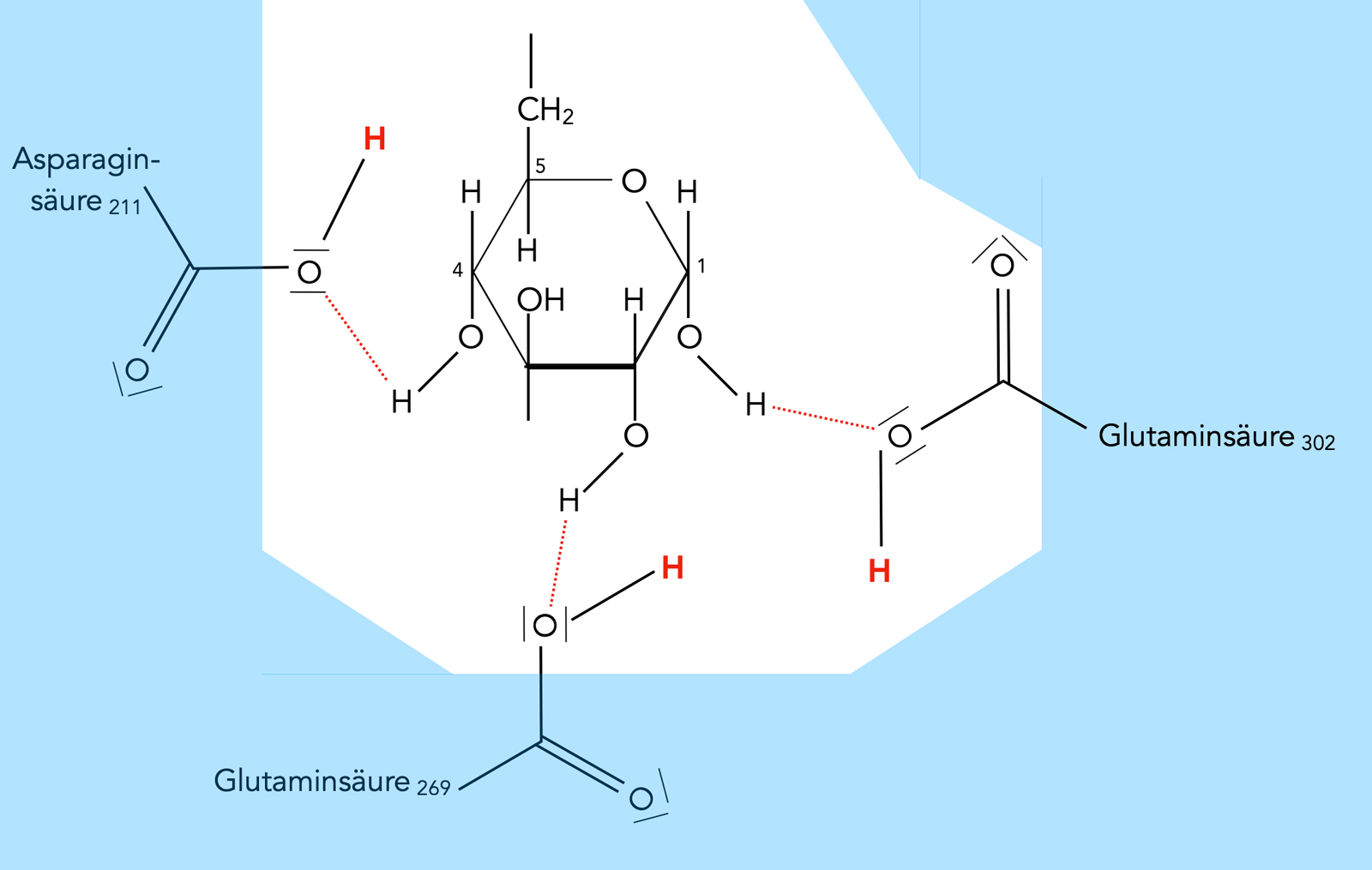
Die Hexokinase hat im aktiven Zentrum zwei "Taschen". In die eine Tasche passt das ATP-Molekül, in die andere, direkt damit verbundene Tasche das Glucose-Molekül. Beide Taschen bilden zusammen das aktive Zentrum der Hexokinase.
Das ATP-Molekül wird durch die Seitenketten von drei Aminosäuren der Hexokinase fixiert, nämlich durch Serin an Position 419, Threonin an Position 234 und Lysin an Position 176.
Das Glucose-Molekül wird auf ähnliche Weise durch drei weitere Aminosäuren fixiert, nämlich durch Asparagin211, Glutaminsäure269 und Glutaminsäure302. Die OH-Gruppe am sechsten C-Atom der Glucose bildet eine H-Brücke zu dem "unteren" O-Atom des hier gezeigten Phosphatrests.
Ganz so einfach wie in dem Markl-Schulbuch dargestellt ist die Sache allerdings nicht, zumindest laut [4]. Normalerweise bilden sich H-Brücken zwischen den OH-Gruppen der Glucose bzw. den O-Atomen des ATP und OH- sowie NH2- und OH-Gruppen der Enzym-Seitenketten. Bei der Hexokinase gibt es jedoch eine Besonderheit: Das ATP bildet eine H-Brücke zu einem H2O-Molekül aus, und das H2O-Molekül ist seinerseits über eine zweite H-Brücke mit einer Aminosäure des Enzyms verbunden (Wasser-vermittelte H-Brücke) [4].
Hemmung der Hexokinase durch zu niedrigen pH-Wert
Bei zu niedrigen pH-Werten verliert die Hexokinase ihre Enzymaktivität. Das folgende Bild zeigt, wieso das der Fall ist [6].
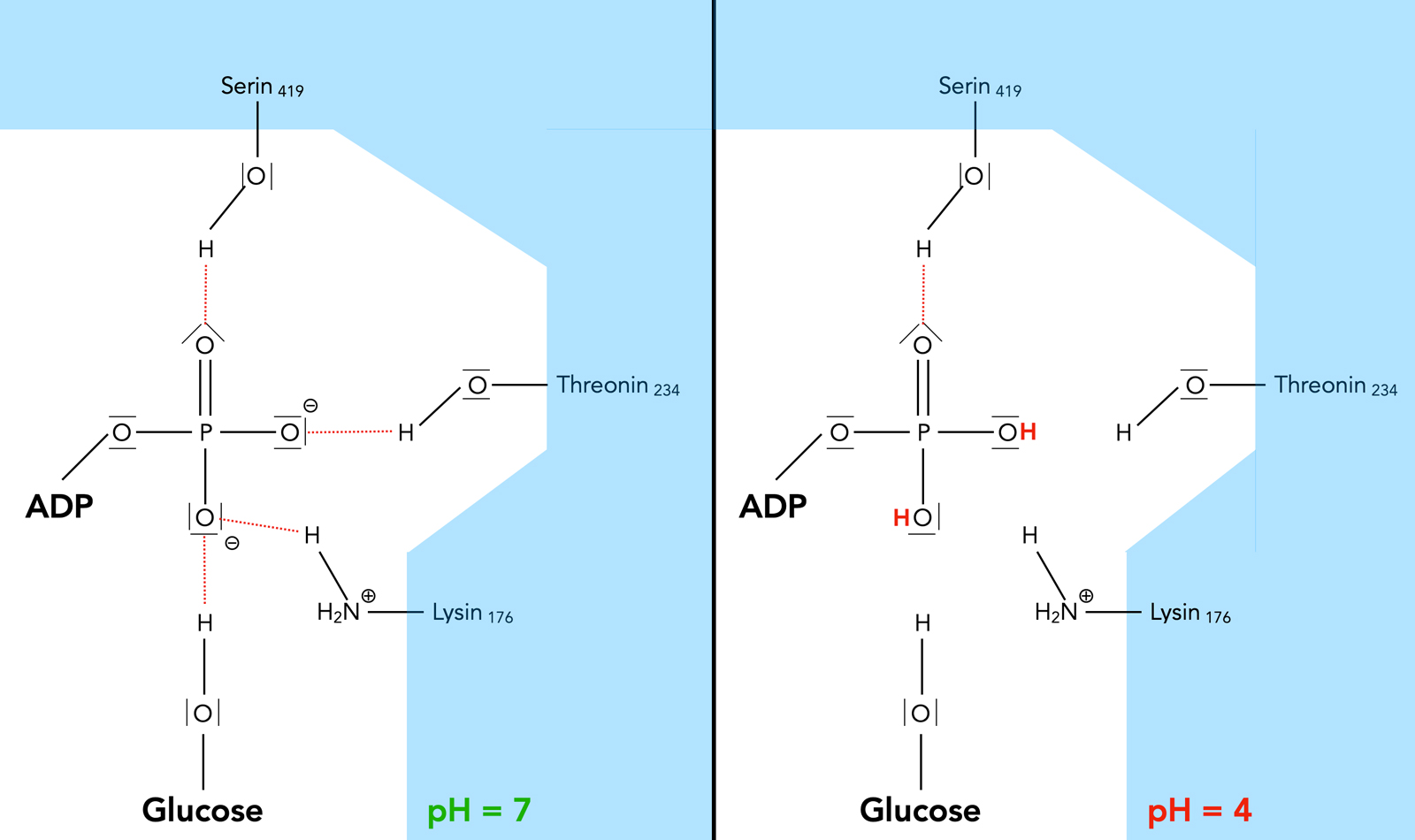
Veränderungen in der ATP-Tasche der Hexokinase bei Absenken des pH-Wertes
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Links sehen wir die Verhältnisse bei einem neutralen pH-Wert von 7, wie oben beschrieben.
Ist das Reaktionsmedium nun zu sauer, lagern sich die im Überschuss vorhandenen Protonen an die negativ geladenen Sauerstoff-Atome des Phosphat-Restes des ATP-Moleküls an. Die H-Brücken, die das ATP-Molekül bisher fixiert haben, existieren dann nicht mehr, wie man im linken Teil des Bildes gut sehen kann. Auch die H-Brücke zwischen der Glucose und dem ATP hört bei einem niedrigen pH-Wert auf zu existieren.
Die negativ geladenen O-Atome der drei sauren Aminosäuren, die die Glucose festhalten, werden bei pH 4 ebenfalls protoniert und können dann die Glucose nicht mehr so gut binden.
Kritisch könnte man hier anmerken, dass die Protonierung eines negativ geladenen Sauerstoff-Atoms nicht unbedingt dazu führt, dass dieses O-Atom keine H-Brücken mehr ausbilden kann.
Die Glucose-Tasche bei einer hohen Protonenkonzentration
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Hier sehen wir die Glucose-Tasche bei einem pH-Wert von 4. Die COO--Gruppen der drei Aminosäuren sind protoniert, liegen also jetzt als COOH-Gruppen vor. Die negativ polarisierten O-Atome der COOH-Gruppen können aber trotzdem H-Brücken mit den positiv polarisierten H-Atomen der Glucose-OH-Gruppen bilden - zumindest theoretisch. Ganz so einfach, wie im Schulbuch erklärt, kann sich die Ansäuerung des Mediums also nicht auf die Substratbindung der Hexokinase auswirken.
Isoformen der Hexokinase
Hexokinasen kommen sowohl bei den Prokaryoten wie auch bei den Eukaryoten vor. In Säugetieren kommen sie in vier Isoformen vor, die als I, II, III und IV bezeichnet werden. Isoenzyme sind Enzyme, welche die gleiche Reaktion katalysieren, also in ihrer Substratspezifität und Wirkungsspezifität übereinstimmen, aber von unterschiedlichen Genen codiert werden, die sich in ihrer Basensequenz unterscheiden, wobei sich die Unterschiede aber in Grenzen halten. Genduplikation mit anschließenden Mutationen sind vermutlich für die Bildung von Isoenzymen verantwortlich.
Die Isoform IVunterscheidet sich von den drei anderen Isoformen dadurch, dass sie aus nur einer Untereinheit besteht und damit auch nur die halbe Masse hat wie die anderen drei Isoformen. Diese spezielle Isoform IV ist auch als Glucokinase bekannt und kommt hauptsächlich in der Leber vor. Der KM-Wert der Glucokinase ist ca. 100 mal größer als der KM-Wert der anderen Isoformen, das heißt, die Glucokinase wird erst bei recht hohen Glucose-Konzentrationen an ihre Grenzen kommen.
Dieses tolle englischsprachige YouTube-Video geht über alles hinaus, was in den gängigen Lehrbüchern der Biochemie (Lehninger, Stryer etc.) geschrieben wird. Sehr empfehlenswert!
Quellen:
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Hexokinase: A VR Experience (2D version)
- engl. Wikipedia: Hexokinase.
- Jürgen Markl et al., Markl Biologie Oberstufe Gesamtband, Klett-Verlag, Stuttgart, Leipzig 2023