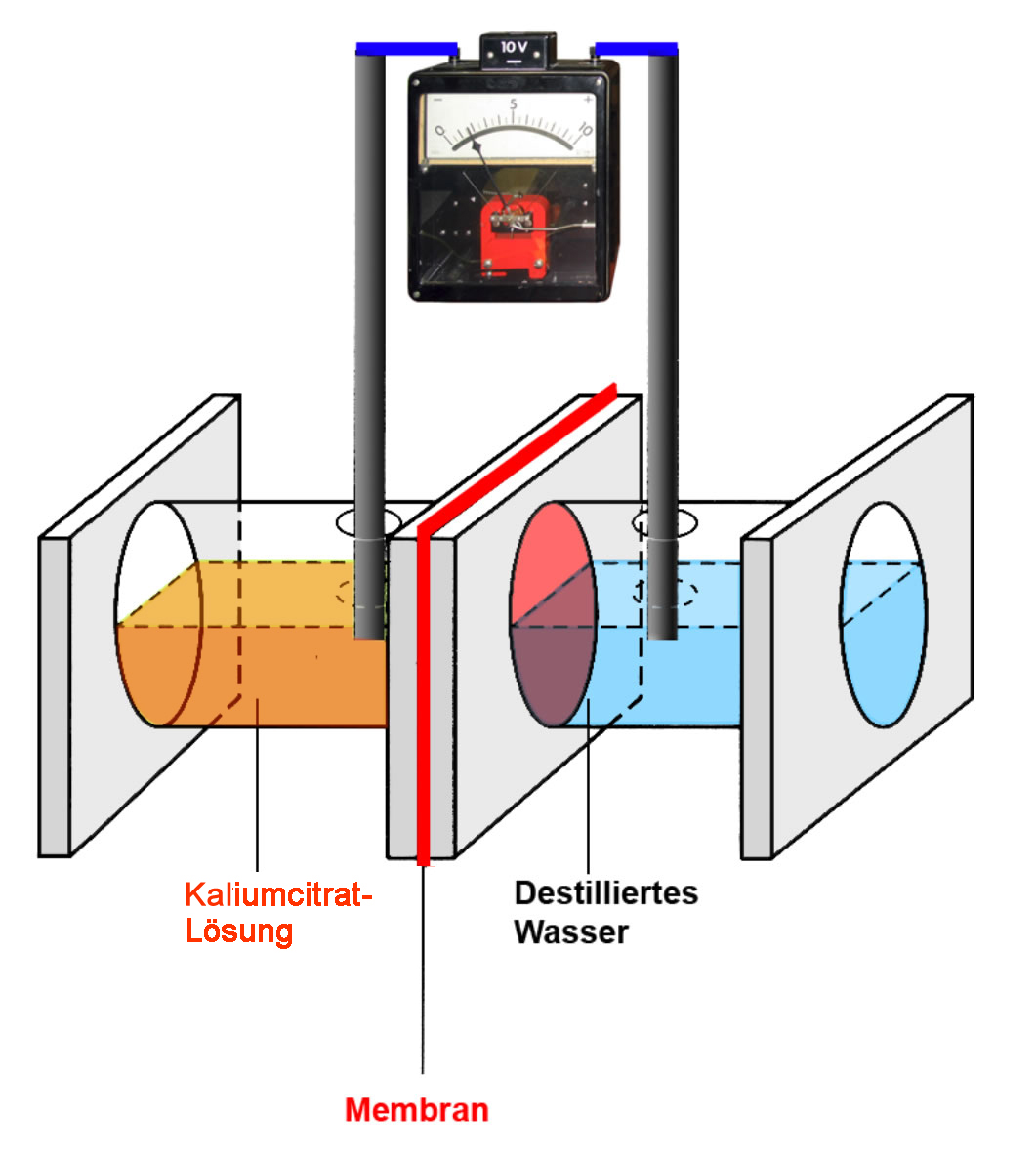
Messung eines Gleichgewichtspotenzials
Die Bildung eines Gleichgewichtspotenzials wurde auf den Seiten zum Ruhepotenzial ausführlich besprochen. Schauen wir uns dazu noch einmal kurz den Modellversuch 2 an:
Links befindet sich ein Gefäß mit einer Kaliumcitrat-Lösung, rechts ein Gefäß mit destilliertem Wasser. Beide Gefäße sind über eine semipermeable Membran miteinander verbunden, die nur die kleinen K+-Ionen durchlässt, nicht aber die großen Citrat-Anionen.
Eine Messelektrode befindet sich in dem linken Gefäß, eine zweite Messelektrode in dem rechten. Zu Beginn des Versuchs kann keine Spannung gemessen werden, U = 0 V.
Nun diffundieren einige wenige K+-Ionen mit dem Konzentrationsgefälle nach rechts in das dest. Wasser. Es findet eine Ladungstrennung statt: Das rechte Gefäß lädt sich positiv auf, im linken Gefäß fehlen diese positiven Ladungen, daher überwiegen jetzt die negativen Ladungen. Dieser Ladungsunterschied zwischen der linken Seite (negativ) und der rechten Seite (positiv) wird als Membranpotenzial oder Membranspannung bezeichnet und in Volt oder Millivolt gemessen.
Elektrisches Potenzial
Ein anderes Wort für elektrische Spannung ist auch elektrisches Potenzial. Damit soll zum Ausdruck gebracht werden, dass eine solche Spannung in der Lage ist, Arbeit zu verrichten.
In der Technik nutzt man elektrische Potenziale beispielsweise aus, um Elektromotoren zu betreiben. In der Zelle können solche elektrischen Potenziale andere Teilchen gegen ihr Konzentrationsgefälle transportieren, also einen aktiven Transport antreiben, oder andere Arbeit leisten.
Dieses elektrische Potenzial , das sich durch die Diffusion einiger K+-Ionen aufgebaut hat, wirkt nun dem chemischen Potenzial der K+-Ionen entgegen.
Chemisches Potenzial
Ein anderes Wort für Konzentrationsunterschied oder Konzentrationsgradient ist chemisches Potenzial. Damit soll zum Ausdruck gebracht werden, dass ein Konzentrationsgradient in der Lage ist, Arbeit zu leisten. Wenn die Teilchen, die für den Konzentrationgradienten verantwortlich sind, auf die Seite mit der geringeren Konzentration diffundieren, ist das eine solche Arbeit.
Elektrochemisches Potenzial
Bei der Diffusion der K+-Ionen müssen wir also stets zwei Potenziale berücksichtigen: Das elektrische (die Spannung) und das chemische (der Konzentrationsgradient).
Am Anfang, wenn noch keine K+-Ionen diffundiert sind, ist das chemische Potenzial maximal, während das elektrische Potenzial gleich Null ist.
Mit jedem K+-Ion, das von links nach rechts diffundiert, nimmt das chemische Potenzial aber ab (der Konzentrationsunterschied wird kleiner), während das elektrische Potenzial zunimmt (durch die Ladungstrennung).
Beide Potenziale können in kJ (Kilojoule) gemessen werden, der bekannten Energieeinheit. Daher kann man die Werte des chemischen Potenzials und des elektrischen Potenzials auch miteinander verrechnen und kommt dann zum elektrochemischen Potenzial, das die Summe des elektrischen und des chemischen Potenzials ist.
Zu Beginn des Versuchs setzt sich das elektrochemische Potenzial nur aus dem chemischen Potenzial zusammen, da das elektrische Potenzial noch den Wert 0 hat.
Mit jedem K+-Ion, das nach rechts diffundiert, wird das chemische Potenzial aber kleiner (der Konzentrationsunterschied verringert sich ja), während das elektrische Potenzial immer größer wird (mit jedem K+-Ion, das nach rechts gelangt, wird der Ladungsunterschied zwischen linker und rechter Seite größer).
Elektrochemisches Gleichgewicht
Irgendwann ist ein Zeitpunkt erreicht, an dem beide Potenziale den gleichen Wert haben.
elektrisches Potenzial = chemisches Potenzial
Das elektrische Potenzial, das die K+-Ionen nach links zurück zieht (weil die linke Gefäßhälfte negativ geladen ist), ist dann genau so groß wie das chemische Potenzial, das die K+-Ionen nach rechts treibt (weil die Konzentration rechts geringer ist als links).
Diesen Zustand bezeichnet man als elektrochemisches Gleichgewicht. Die Spannung, die man in diesem Gleichgewichtszustand messen kann, wird dann als Gleichgewichtspotenzial bezeichnet. Wenn ausschließlich K+-Ionen diffundieren, wie in unserem Beispiel, wird das Gleichgewichtspotenzial auch als Gleichgewichtspotenzial von K+ bezeichnet.
Dynamisches Gleichgewicht
Das eben beschriebene elektrochemische Gleichgewicht ist ein dynamisches Gleichgewicht. Für den außenstehenden Betrachter ändert sich nichts mehr, weder die Konzentrationen in den Gefäßhälften noch die gemessene Spannung ändern sich.
Ein Beobachter, der in der Lage wäre, die einzelnen Ionen zu beobachten, würde allerdings etwas völlig anderes feststellen. Die K+-Ionen bewegen sich ständig hin und her. Sie können die Membran in beide Richtungen passieren. "dynamisches Gleichgewicht" heißt hier lediglich, dass pro Zeiteinheit genau so viele Ionen von links nach rechts diffundieren wie von rechts nach links.
Im Alltag kennt man ein solches dynamisches Gleichgewicht z.B. von einem Waschbecken, das zur Hälfte mit Wasser gefüllt ist. Lässt man nun das Wasser ab und dreht gleichzeitig den Wasserhahn so auf, dass genau so viel Wasser zuläuft wie durch den Abfluss abläuft, dann ändert sich die Höhe des Wasserspiegels nicht. Trotzdem fließen ständig Wasser-Moleküle ab, während gleichzeitig genau so viel neue dazukommen.
Berechnung des Gleichgewichtspotenzials von K+-Ionen
Die Berechnung eines Gleichgewichtspotenzials erfolgt nach Nernst folgendermaßen:
$E_{K} = -\frac{R*T}{F} * \ log(\frac{K^{+}_{innen}}{K^{+}_{außen}})$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
R ist dabei die sogenannte Gaskonstante, T die absolute Temperatur, gemessen in Kelvin und F die Faradaykonstante. $K^{+}_{innen}$ und $K^{+}_{außen}$ sind die Konzentrationen der Kalium-Ionen im Außenmedium und im Innern der Nervenzelle.
Bei einer Temperatur von 37 ºC, wie sie beispielsweise in menschlichen Zellen herrscht, vereinfacht sich der Ausdruck zu
$E_{K} = -61mV \ * \ log(\frac{K^{+}_{innen}}{K^{+}_{außen}})$
Der Term -61 mV berechnet sich aus -RT/F für T = 310 K (37 ºC). Für Zimmertemperatur (20 ºC) müsste man stattdessen -58 mV einsetzen.
Schauen wir uns jetzt mal die Konzentrationsverhältnisse an/in einer menschlichen Nervenzelle an. Im Zellplasma der Nervenzelle herrscht eine Konzentration von ca. 155 mmol/l, im Außenmedium eine Konzentration von 4 mmol/l [1]. Setzen wir diese Wert mal in die vereinfachte Nernst-Gleichung ein, dann erhalten wir
$E_{K} = -61mV \ * \ log(\frac{155\ mol/l}{4 \ mol/l})$
Als Ergebnis erhalten wir dann -96,88 mV. Das ist das Gleichgewichts-Kaliumpotenzial. Und dieser Wert wäre auch das Ruhepotenzial der menschlichen Nervenzelle, wenn das Ruhepotenzial ausschließlich von der Kalium-Diffusion abhängen würde.
Jetzt sollte Ihnen vielleicht auch klar werden, warum das negative Vorzeichen vor dem Ausdruck
$\frac{R*T}{F}$
notwendig ist. Das gemessene Ruhepotenzial einer Nervenzelle ist ja auch negativ, und durch die Verwendung des negativen Vorzeichens erhält man auch mit dieser Gleichung einen entsprechenden negativen Wert.
Berechnung des Gleichgewichtspotenzials der Na+-Ionen
Hier müssen wir die Na+-Konzentrationen einsetzen, wie sie an einer Nervenzelle herrschen: Im Zellplasma 12 mmol/l, im Außenmedium 145 mol/l. Bei einer Temperatur von 37 ºC erhalten wir:
$E_{Na} = -61mV \ * \ log(\frac{Na^{+}_{innen}}{Na^{+}_{außen}})$
Setzen wir diese Wert mal in die Nernst-Gleichung ein, dann erhalten wir
$E_{Na} = -61mV \ * \ log(\frac{12\ mol/l}{145 \ mol/l}) = +66 mV$
Diese +66 mV sind das Gleichgewichts-Potenzial der Na+-Ionen. Auf diesen Wert könnte ein Aktionspotenzial theoretisch hochschießen, wenn ausschließlich die Natrium-Ionen an den Vorgängen beteiligt wären, was ja aber nicht der Fall ist.
Für die Entstehung des Ruhepotenzial sind nicht nur die K+- und die Na+-Ionen verantwortlich, sondern auch die Cl--Ionen sowie - in geringerem Maße - auch die Calcium-Ionen und die Protonen. Außerdem haben die unterschiedlichen Membranpermeabilitäten für die verschiedenen Ionen einen entscheidenden Einfluss auf das Ruhepotenzial. Wie man all diese Ionenkonzentrationen und -permeabilitäten in einer einzigen Gleichung vereinigt, wird auf dieser Seite erklärt.