Calmodulin ist ein relativ kleines Protein aus 148 Aminosäuren, die in zwei Domänen organisiert sind. Jede Domäne wiederum besteht aus zwei EF-Hand-Motiven (zwei α-Helices und eine β-Faltblatt-Struktur), und jedes EF-Motiv kann ein Calcium-Ion binden. Das gesamte Calmodulin-Molekül ist also in der Lage, vier Ca2+-Ionen zu binden.
Der Name "Calmodulin" ist eine Abkürzung für "Calcium moduliertes Protein".
Im Cytoplasma herrscht normalerweise eine sehr geringe Ca2+-Konzentration. Wenn aber die Ca2+-Konzentration über den Wert von 0,5 mmol ansteigt, setzen sich Calcium-Ionen an das Protein und aktivieren es dadurch.
Wenn das Calmodulin mit Calcium-Ionen besetzt ist, ändert es seine Konformation. Hydrophobe Stellen, die vorher im Innern des Proteins verborgen waren, befinden sich jetzt außen und können an andere Proteine binden, vorwiegend an hydrophobe α-Helices von bestimmten Enzymen.
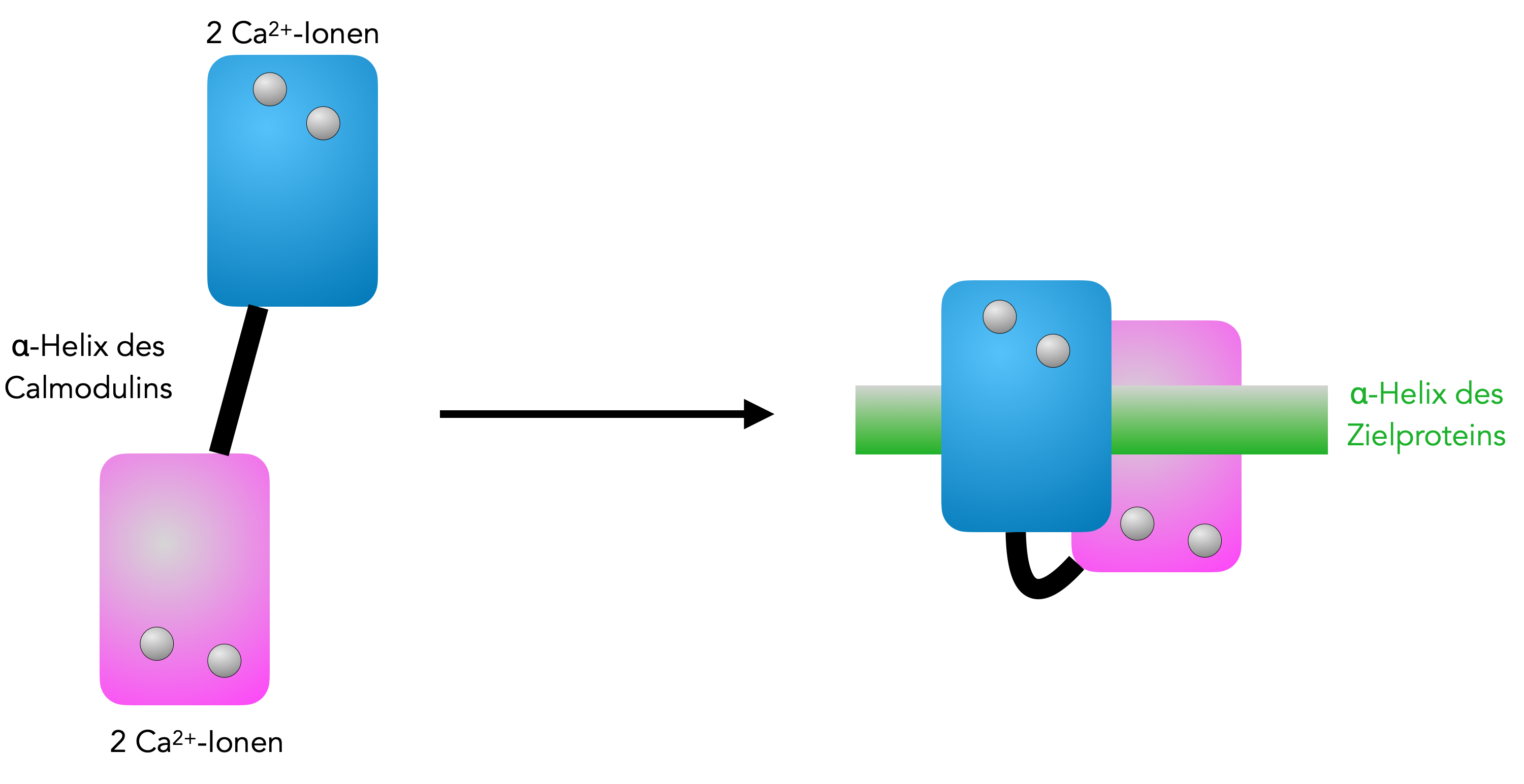
Durch Aufnahme der Ca2+-Ionen ändert Calmodulin seine Konformation
Autor: Ulrich Helmich 11/2023, Lizenz: Public domain
Wenn sich ein Ca2+/Calmodulin-Komplex an die alpha-Helix eines Proteins bindet und dabei seine Konformation ändert (siehe Abb. 1), dann kann das bei diesem Protein ebenfalls eine Konformations-Änderung auslösen, welche dieses Protein dann aktiviert.
Besonders hervorzuheben sind hier die calmodulinabhängigen Proteinkinasen (CaM-Kinasen). Proteinkinasen sind Enzyme, die andere Proteine (und damit auch viele Enzyme) phosphorylieren können. Auch bei diesen CaM-Kinasen bindet der Ca2+/Calmodulin-Komplex an eine außenliegende α-Helix.
Auch die bekannte Adenylatcyclase , die den second messenger cAMP aus ATP herstellt, kann durch den Ca2+/Calmodulin-Komplex aktiviert werden. Interessanterweise wird auch die Phosphodiesterase, der Gegenspieler der Adenylatcyclase, durch Ca2+/Calmodulin aktiviert, allerdings erst bei deutlich höheren Ca2+-Konzentrationen als die Adenylatcyclase.
Quellen:
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Marme, "Calcium, Calmodulin und ihre zelluläre Funktion". Biologie in unserer Zeit 3/1981.