Bacteriorhodopsin ist ein Transmembranprotein in der Zellmembran des extremophilen Bakteriums Halobacterium salinarum.
Struktur
Das Protein besteht aus 248 Aminosäuren, die in sieben Transmembran-Helices organisiert sind. In der Pore, die aus den sieben Helices gebildet wird, befindet sich ein Retinal-Molekül, das kovalent an eine Lysin-Seitenkette an Position 216 gebunden ist [1,2].

Das Bacteriorhodopsin-Molekül mit einem Retinal in der Mitte (violett)
Autor: Darekk2, Lizenz: CC Attribution-Share Alike 3.0 Unported license.
Image of PDB (Protein Data Bank) ID 1X0S (Nishikawa, T., Murakami, M., Kouyama, T. (2005) Crystal structure of the 13-cis isomer of bacteriorhodopsin in the dark-adapted state. J.Mol.Biol. 352: 319-328) created with RasTop (Molecular Visualization Software).
Auf diesem Bild aus der Wikipedia [1] sieht man sehr schön die sieben Helices, aus denen sich das Bacteriorhodopsin zusammensetzt. In der Mitte dieses Gebildes sieht man in Violett das Retinal-Molekül, das wir uns nun als Nächstes anschauen.
Das Retinal-Molekül
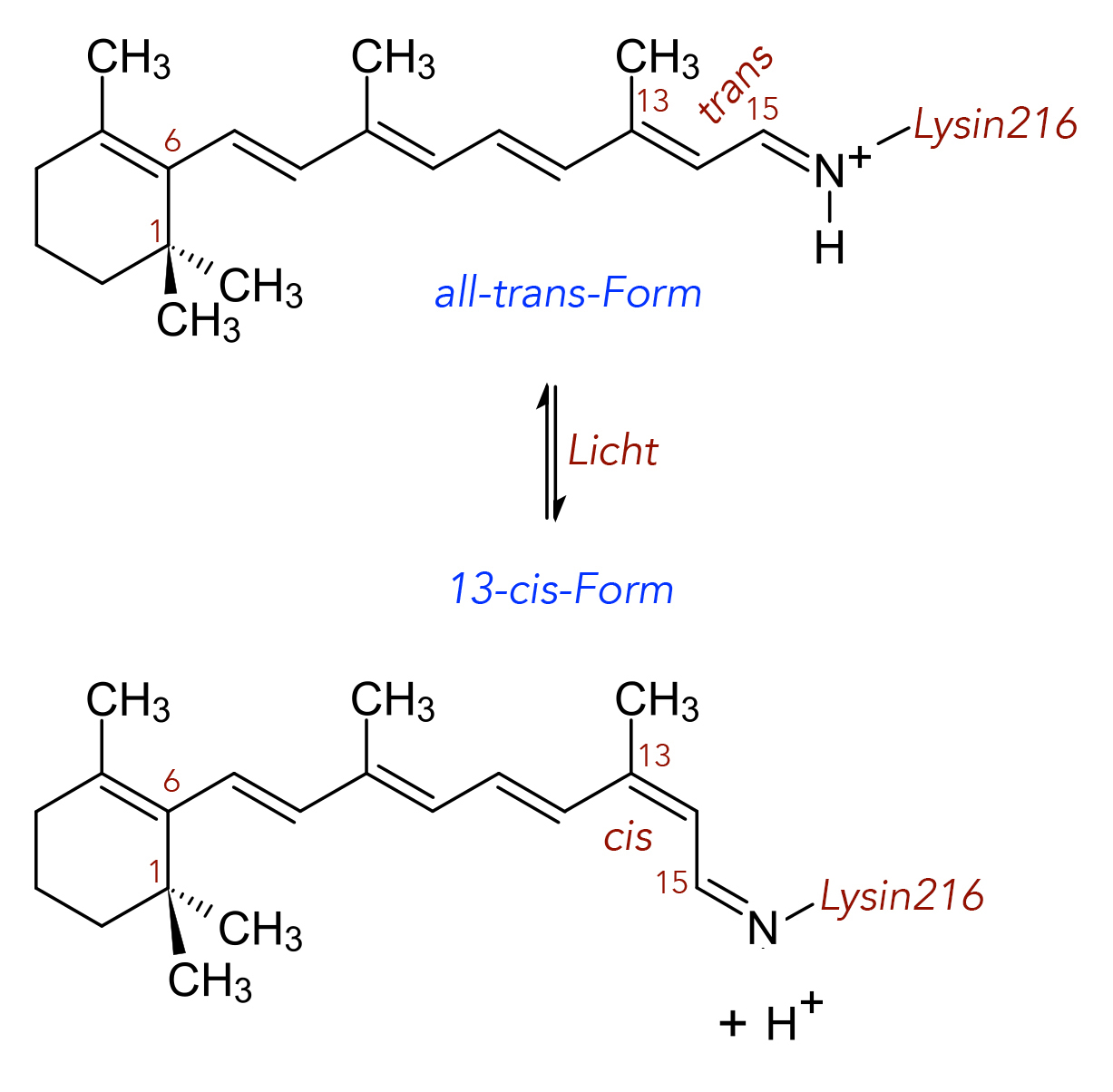
cis-trans-Isomerie bei dem Retinal
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das Retinal ist ein Aldehyd, allerdings kann man hier die CHO-Gruppe nicht mehr sehen, weil sie mit der NH2-Gruppe der Lysin-Seitenkette reagiert hat. In der unbelichteten Form liegt die lange Kohlenstoff-Kette des Retinals in der so genannten all-trans-Form vor, das Retinal wird demzufolge als all-trans-Retinal bezeichnet. Alle C=C-Doppelbindungen des Moleküls befinden sich also in der trans-Form.
Bei Absorption von Licht verändert sich die Konstitution des Moleküls jedoch. Die C=C-Doppelbindung zwischen den C-Atomen 13 und 14 wird aufgelöst und dann wieder hergestellt, aus der trans-Doppelbindung wird eine cis-Doppelbindung. Außerdem wird ein Proton bei diesem Vorgang abgegeben, was noch sehr wichtig ist, wie wir später sehen werden. Diese Form des Retinals nennt man jetzt 13-cis-Retinal.
Der eben geschilderte Vorgang ist reversibel, wie man an den typischen Gleichgewichts-Pfeilen erkennen kann.
Organisation des Proteins
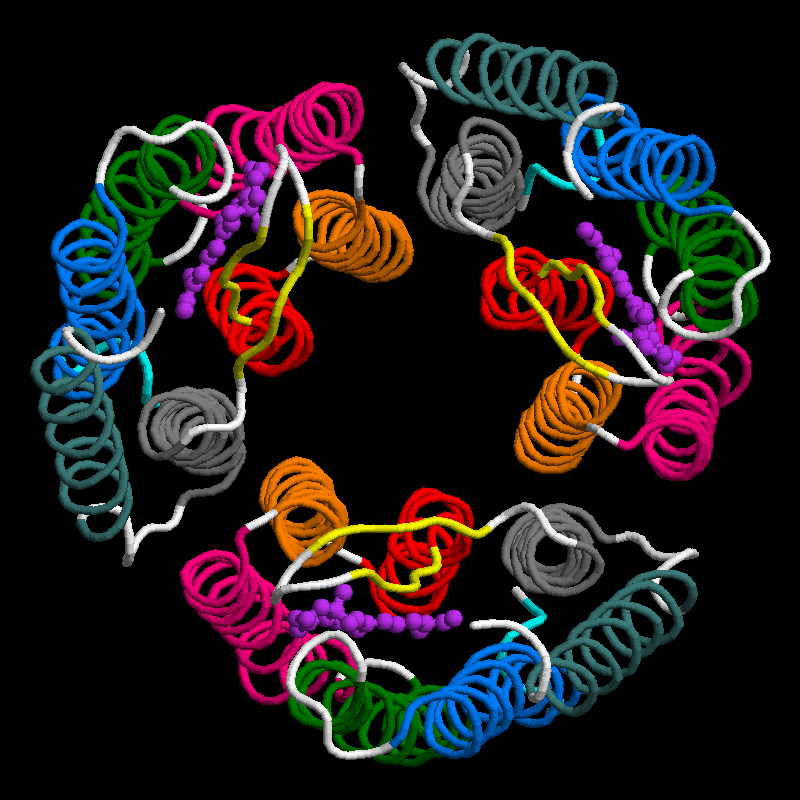
Drei Bacteriorhodopsin-Moleküle bilden zusammen ein Trimer, und viele dieser Trimere bilden in der Membran ein mehr oder weniger kristallines zweidimensionales hexagonales Muster aus, das als Purpurmembran bezeichnet wird. Diese Purpurmembran-Bereiche können bis zu 5 µm groß sein, das ist für eine Membran schon "riesig" [1].
Das Bacteriorhodopsin-Molekül mit einem Retinal in der Mitte (violett)
Autor: Darekk2, Lizenz: CC Attribution-Share Alike 3.0 Unported license.
Image of PDB (Protein Data Bank) ID 1X0S (Nishikawa, T., Murakami, M., Kouyama, T. (2005) Crystal structure of the 13-cis isomer of bacteriorhodopsin in the dark-adapted state. J.Mol.Biol. 352: 319-328) created with RasTop (Molecular Visualization Software).
Auf diesem Bild sehen wir ein solches Bacteriorhodopsin-Trimer, und mit Photoshop konstruieren wir uns nun einen winzigen Ausschnitt aus der Purpurmembran:

Ein Ausschnitt aus der Purpurmembran
Autor: Darekk2, verändert von Ulrich Helmich, Lizenz: CC Attribution-Share Alike 3.0 Unported license.
So ungefähr kann man sich den Aufbau der Purpurmembran vorstellen. Elektronenmikroskopische Photos sehen in der Tat ähnlich aus, sind dann natürlich nicht farbig, sondern schwarz-weiß. In einem öffentlich zugänglichen Artikel auf ResearchGate [3] finden Sie eine ganze Reihe von Zeichnungen zum Bacteriorhodopsin und zur Purpurmembran. Insgesamt ist die Purpurmembran (engl.: purple membrane) sehr proteinreich, 75% ihrer Gesamtmasse bestehen aus Proteinen, nur 25% aus Lipiden. Auf jedes einzelne Bacteriorhodopsin-Molekül kommen ca. 10 Lipid-Moleküle, die meisten davon sind vom Archaeol-Typus [2].
Funktion als Protonenpumpe
Weiter oben wurde bereits gesagt, dass das Retinal bei Belichtung in eine 13-cis-Form übergeht und dabei ein Proton abgibt. Diese Abgabe von Protonen an das Außenmedium ist der eigentliche Daseinszweck von Bacteriorhodopsin. Wenn die vielen Bacteriorhodopsin-Trimere belichtet werden, entsteht ein starker Protonengradient quer über die Zellmembran, die Protonenkonzentration im Zellplasma nimmt dabei deutlich ab.
Durch ATPasen in der Zellmembran können die Protonen dann zurück in die Zelle fließen und dabei quasi nebenbei ATP produzieren.
Mechanismus des Protonentransports
Natürlich ist die Beschreibung im obigen Text etwas stark vereinfachend. Das Proton des Retinals wird nicht direkt in das Außenmedium abgegeben, sondern zunächst einmal an einen anderen Aminosäure-Rest des Bacteriorhodopsins, nämlich Asp85 (Asparaginsäure an Position 85). Dann geht es weiter zu Arginin an Position 82. Diese Aminosäure befindet sich schon näher an der Außenseite der Membran. Von dort wird das Proton auf Glutaminsäure an Position 204 oder Position 194 abgegeben (da ist man sich noch nicht so ganz sicher), und von dort gelangt ein Proton schließlich in das Außenmedium.
Gleichzeitig holt sich das 13-cis-Retinal "sein" Proton zurück, und zwar von einer Asparaginsäure-Seitenkette an Position 96, was recht weit auf der cytoplasmatischen Seite der Membran ist. Die Asparaginsäure holt sich ihr Proton dann aus dem Cytoplasma zurück [2].
Insgesamt betrachtet ist durch die Belichtung eines Retinal-Moleküls also ein Proton vom Cytoplasma in das Außenmedium transportiert worden.
Die Konformation des Bacteriorhodopsins wird während dieser Schritte ständig verändert, in der Fachliteratur findet man bis zu sechs verschiedene Zustände des Bacteriorhodopsin-Moleküls.
Photosynthese an der Purpurmembran
Die Bacteriorhodopsin-Moleküle der Purpurmembran werden durch Absorption von Licht dazu gebracht, Protonen vom Cytoplasma in das Außenmedium zu transportieren. Der so erzeugte Protonengradient dient dann zur Synthese von ATP, indem die Protonen durch bestimmte Membranproteine, die ATPasen, zurück in die Zelle diffundieren.
Quellen:
- engl. Wikipedia, Artikel "Bacteriorhodopsin"
- Luckey, Membrane Structural Biology, 2. Auflage, Cambridge University Press 2014.
- De Queiros Sllveira, Chen, "Energy Transfer Induced by Dye Encapsulation in a Hybrid Nanoparticle-Purple Membrane Reversible Assembly", Advanced Functional Materials 29(43):1904899, October 2019.