Die Standard-Wasserstoff-Halbzelle ist das Bezugssystem für Messungen des Redoxpotenzials. Sie hat definitionsgemäß ein Redoxpotenzial von 0 Volt.
Aufbau
Die folgende Abbildung zeigt schematisch den Aufbau einer Wasserstoff-Halbzelle, die oft auch als Wasserstoff-Elektrode bezeichnet wird, was aber nicht ganz hundertprozentig korrekt ist.
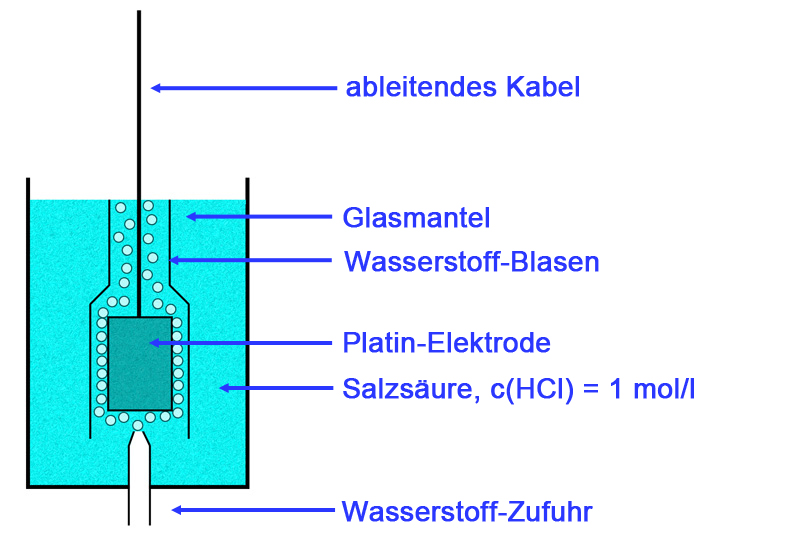
Schematische Darstellung einer Wasserstoff-Halbzelle
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
In einem Gefäß mit Salzsäure der Konzentration c(HCl) = 1 mol/l befindet sich eine Platin-Elektrode. Das Platin nimmt nicht an den Reaktionen in der Wasserstoff-Halbzelle teil, sondern dient nur als Träger für den Wasserstoff.
Von unten strömt Wasserstoff-Gas um die Platin-Elektrode, die Gasbläschen bilden eine Art Mantel um das Metall herum, welcher dann die eigentliche Elektrode darstellt.
Genauer gesagt, wird der gasförmige Wasserstoff von dem Platin adsorbiert und bildet dann eine extrem dünne H2-Schicht, viel dünner, als die Abbildung andeutet.
Reaktionen
In der Wasserstoff-Halbzelle läuft folgende Reaktion ab:
$2 \ H_3O^{+} + 2 \ e^{-} \rightleftharpoons 2 \ H_2O + H_2$
Verbindet man die Wasserstoff-Halbzelle mit der Halbzelle eines unedlen Metalls, beispielsweise Zink, dann läuft in der Wasserstoff-Halbzelle die obige Reaktion von links nach rechts ab. Die von der Zink-Halbzelle freigesetzten Elektronen reduzieren die Oxonium-Ionen der Salzsäure zu Wasser und Wasserstoff.
Verbindet man die Wasserstoff-Halbzelle dagegen mit der Halbzelle eines edlen Metalls, beispielsweise Kupfer, dann läuft in der Wasserstoff-Halbzelle die Reaktion von rechts nach links ab. Die von der Kupfer-Halbzelle benötigten Elektronen oxidieren die H2-Moleküle zu Protonen, die dann aber als Oxonium-Ionen vorliegen.
Noch einmal zur Klarstellung:
- Wasserstoff-Elektrode = der Mantel aus H2-Gas, der sich um die Platin-Elektrode bildet.
- Wasserstoff-Halbzelle = Wasserstoff-Elektrode in Salzsäure.
- Standard-Wasserstoff-Halbzelle = Wasserstoff-Halbzelle mit c(HCl) = 1 mol/l und Normalbedingungen (normaler Druck, Zimmertemperatur).
Echte Wasserstoff-Elektroden sind natürlich etwas anders aufgebaut als die hier abgebildete, aber das Prinzip stimmt schon.