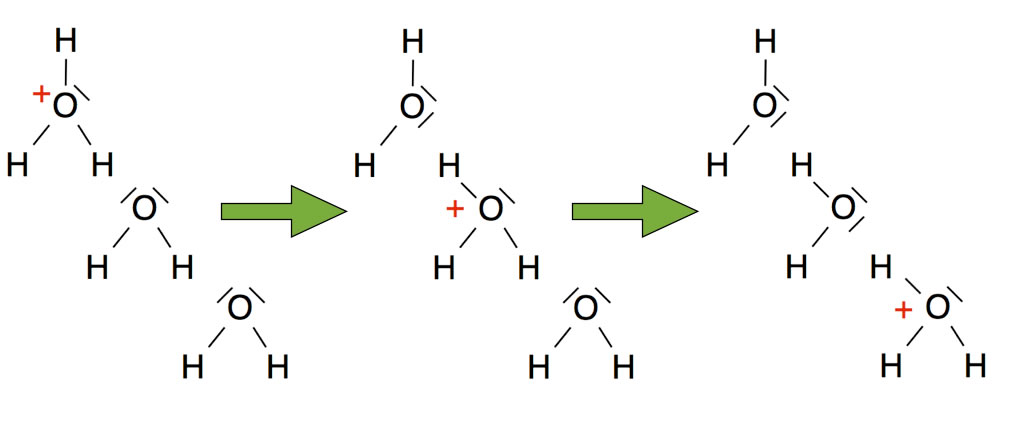
Dieses Bild zeigt den nach Theodor Grotthuß benannten Mechanismus, mit dem in einer wässrigen Lösung die positiven Ladungen der Oxonium-Ionen sehr schnell weitergeleitet werden können. Die Oxonium-Ionen müssen nicht wie andere Ionen durch die Lösung diffundieren, sondern die positive Ladung wird einfach an ein anderes Wasser-Molekül weitergereicht. Dies geschieht - einfach gesprochen - durch "Umklappen" der kovalenten Bindungen zwischen den O- und H-Atomen benachbarter Wasser-Moleküle. In dem entsprechenden Wikipedia-Artikel gibt es eine schöne Animation dazu:
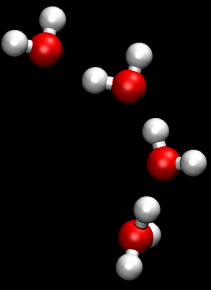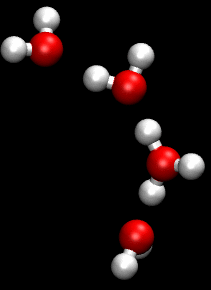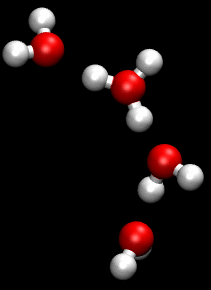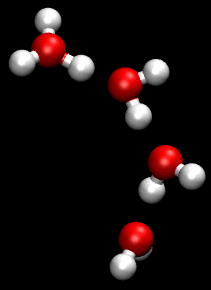
Die Animation zum Grotthuß-Mechanismus aus der Wikipedia
This work has been released into the public domain by its author, Matt K. Petersen a.k.a. w:User:Pigwiggle. This applies worldwide.
Mit dem Kugelwolkenmodell kann man diesen Mechanismus recht anschaulich erklären, der übrigens auch sehr gut die Natur der Wasserstoffbrücken-Bindung verdeutlicht.
Ein H-Atom ist im Wasser-Molekül kovalent an ein O-Atom gebunden. Das O-Atom eines benachbarten Wasser-Moleküls stellt zwei freie Elektronenpaare zur Verfügung, also zwei doppelt besetzte Kugelwolken. Das H-Atom des ersten Moleküls kann nun die Bindung zum ersten Molekül "kappen" und sich in eine der doppelt besetzten Kugelwolken des zweiten Moleküls "hineinsetzen". Dann bildet sich aus dem zweiten Molekül ein Oxonium-Ion. Dieses kann aber auf gleiche Weise wieder ein Proton an das nächste Wasser-Molekül abgeben, so dass dieses zum Oxonium-Ion wird und so weiter.
Dieser Grotthuß-Mechanismus erklärt also sowohl die Natur von Wasserstoffbrücken-Bindungen (H-Atome, die "gleichzeitig" zwei verschiedenen Wasser-Molekülen gehören) wie auch die hohe Ionenleitfähigkeit von Oxonium-Ionen und Hydroxid-Ionen.
Übrigens ist der Mechanismus, den Theodor von Grotthuß (1785-1822) vorgeschlagen hat, sehr alt, er stammt aus dem Jahre 1806. Damals kannte man weder die Summenformel von Wasser noch die Strukturformel. Von Elektronenpaaren, Kugelwolken etc. hatte man überhaupt noch keine Ahnung.
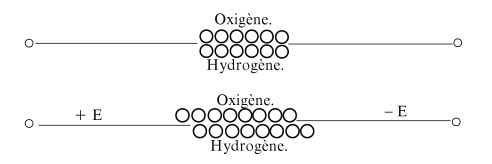
Hier ein Bild aus der Original-Publikation von Grotthuß (1785-1822) aus dem Jahre 1807. Übrigens hatte Volta erst acht Jahre vorher die elektrische Batterie erfunden. Grotthuß stellte sich Wasser als OH vor, also zusammengesetzt aus je einem O-Atom und einem H-Atom (obere Zeichnung). Durch Anlegen einer elektrischen Spannung (E) werden nun die O-Atome zum Pluspol, die H-Atome zum Minuspol verschoben, so wie auf der unteren Zeichnung dargestellt.
Natürlich ist diese Vorstellung falsch, aber für die damalige Zeit geradezu revolutionär, der Zeit weit voraus. Das Interessante ist, dass nach der (falschen) Vorstellung die Leitfähigkeit im Eis wesentlich größer sein müsste als im flüssigen Wasser. Und nun die Überraschung: Die elektrische Leitfähigkeit ist im Eis tatsächlich größer als im flüssigen Wasser, was wahrscheinlich daran liegt, dass die Wasser-Moleküle im Eis in einer hochgeordneten Weise vorliegen, so dass ein Oxonium-Ion das benachbarte Wasser-Molekül schneller "finden" kann als in flüssigem Wasser.
Wieso ist die Leitfähigkeit von Oxonium-Ionen bzw. Protonen höher als die von Hydroxid-Ionen?
Auf diese sehr wichtige Frage findet man bei einer Internet-Recherche so gut wie keine Antwort. In meinem alten Lehrbuch der physikalischen Chemie von Hummel und Moore aus den 70er Jahren des letzten Jahrhunderts bin ich aber auf eine Bemerkung gestoßen, die einer Antwort schon ziemlich nahe kommt.
Die Autoren schreiben, dass die Leitfähigkeit der beiden Ionensorten nicht nur durch den Grotthuß-Mechanismus allein zustande kommt, sondern dass sich die Ionen auch ähnlich wie Natrium- oder Chlorid-Ionen ganz normal durch die Lösung bewegen. Die gemessene Äquivalentleitfähigkeit ist also eine Überlagerung aus Grotthuß-Mechanismus und normaler Ionenwanderung. Nun sind Protonen deutlich kleiner und beweglicher als Hydroxid-Ionen, und das ist es wahrscheinlich, was zur höheren Äquivalentleitfähigkeit der Protonen beiträgt.
Eine andere Idee, die neulich einer meiner Schüler hatte, ist diese: Das H3O+-Ion hat drei benachbarte Wasser-Moleküle, mit denen es H-Brücken bilden kann, das OH--Ion aber nur ein benachbartes Wasser-Molekül. Vielleicht ist das die Ursache für die höhere Leitfähigkeit der Oxonium-Ionen.
Falls jemand eine bessere Antwort auf diese wichtige Frage findet, soll er/sie nicht zögern, mir eine entsprechende Mail zu schicken, damit ich die Antwort hier besprechen kann.