In diesem Foliensatz wird aufgezeigt, wieso bestimmte organische Verbindungen sichtbares Licht absorbieren und dadurch für das menschliche Auge farbig erscheinen. Grundlagen des Orbitalmodells werden hier vorausgesetzt! Im Lauf der Präsentation wird auch auf Molekülorbitale und Grundlagen der MO-Theorie eingegangen. Für schwache Grundkurse ist dieser Foliensatz daher nicht geeignet.
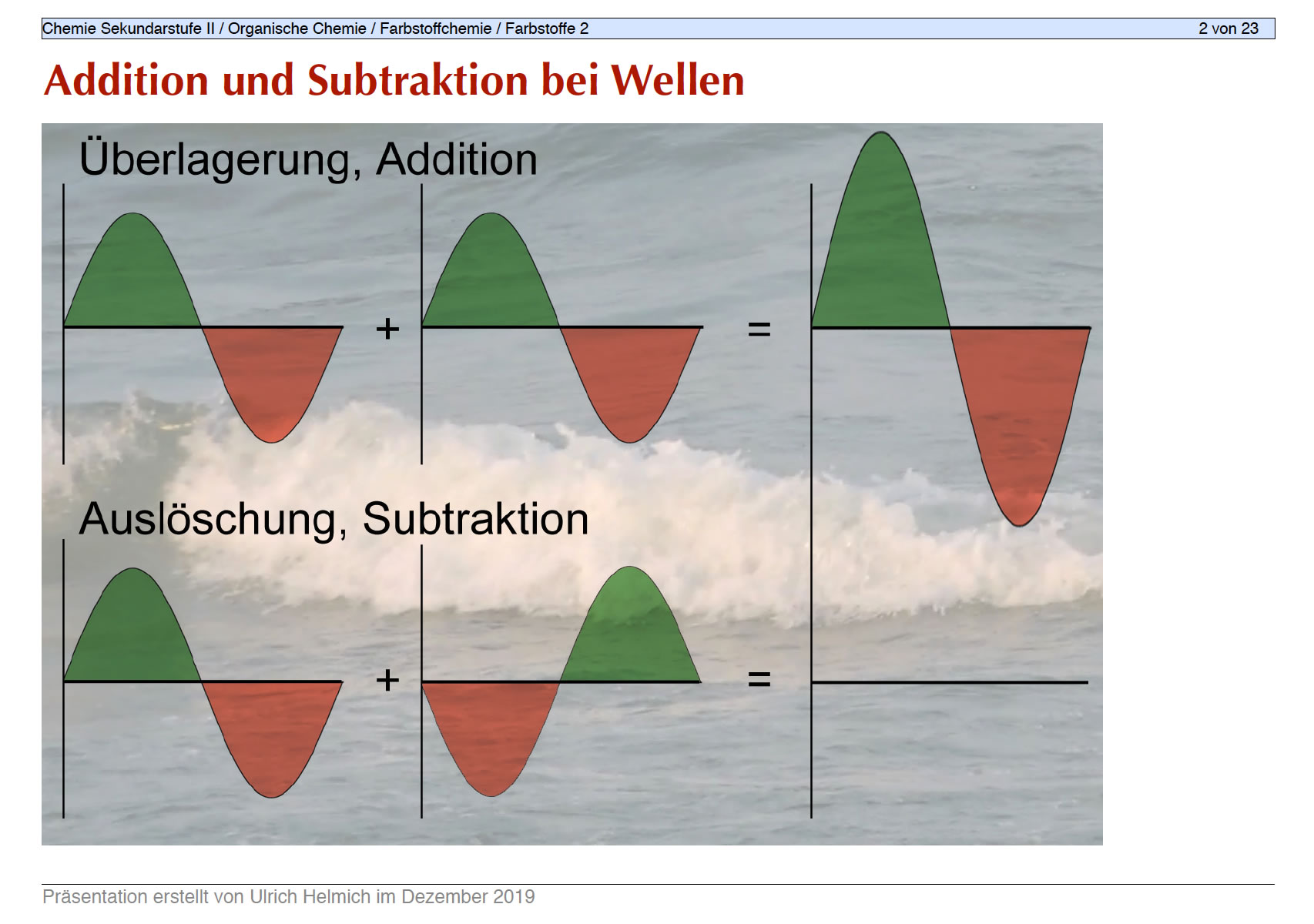
Die Folie 2 aus dem Foliensatz "Farbigkeit organischer Verbindungen"
Auf der Folie 2 wird den Schüler(innen) zunächst an einem analogen Beispiel erklärt, wieso sich zwei Wellen überlagern bzw. auslöschen können (Addition bzw. Subtraktion). Überträgt man dies von eindimensionalen Wellen auf dreidimensionale (Atomorbitale), dann kann man auch die Existenz von bindenden und anti-bindenden Molekülorbitalen erklären:
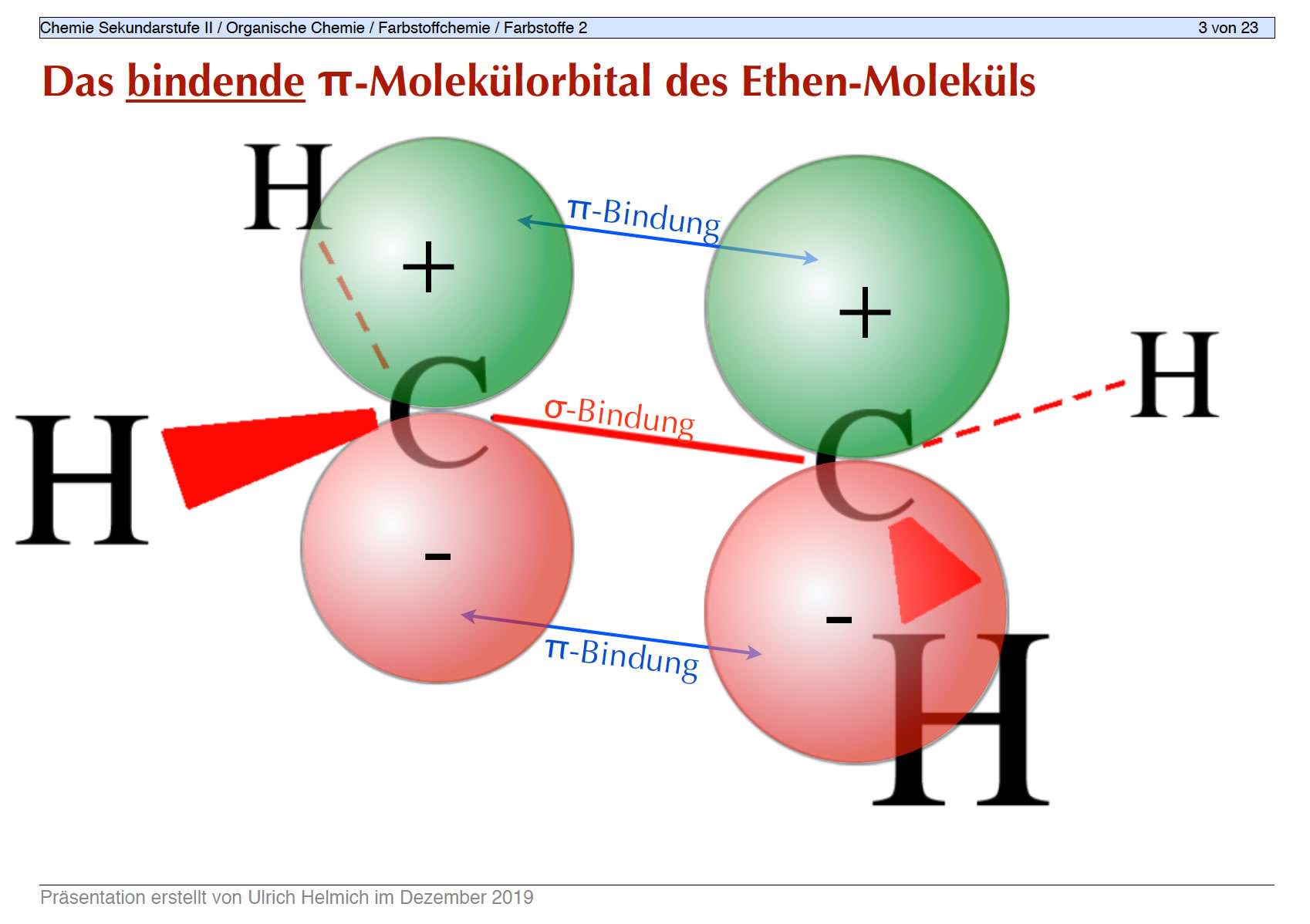
Die Folie 3
Bindende MOs entstehen durch "Addition" der beiden p-Orbitale des Ethen-Moleküls, wenn also beide p-Orbitale gleich ausgerichtet sind.
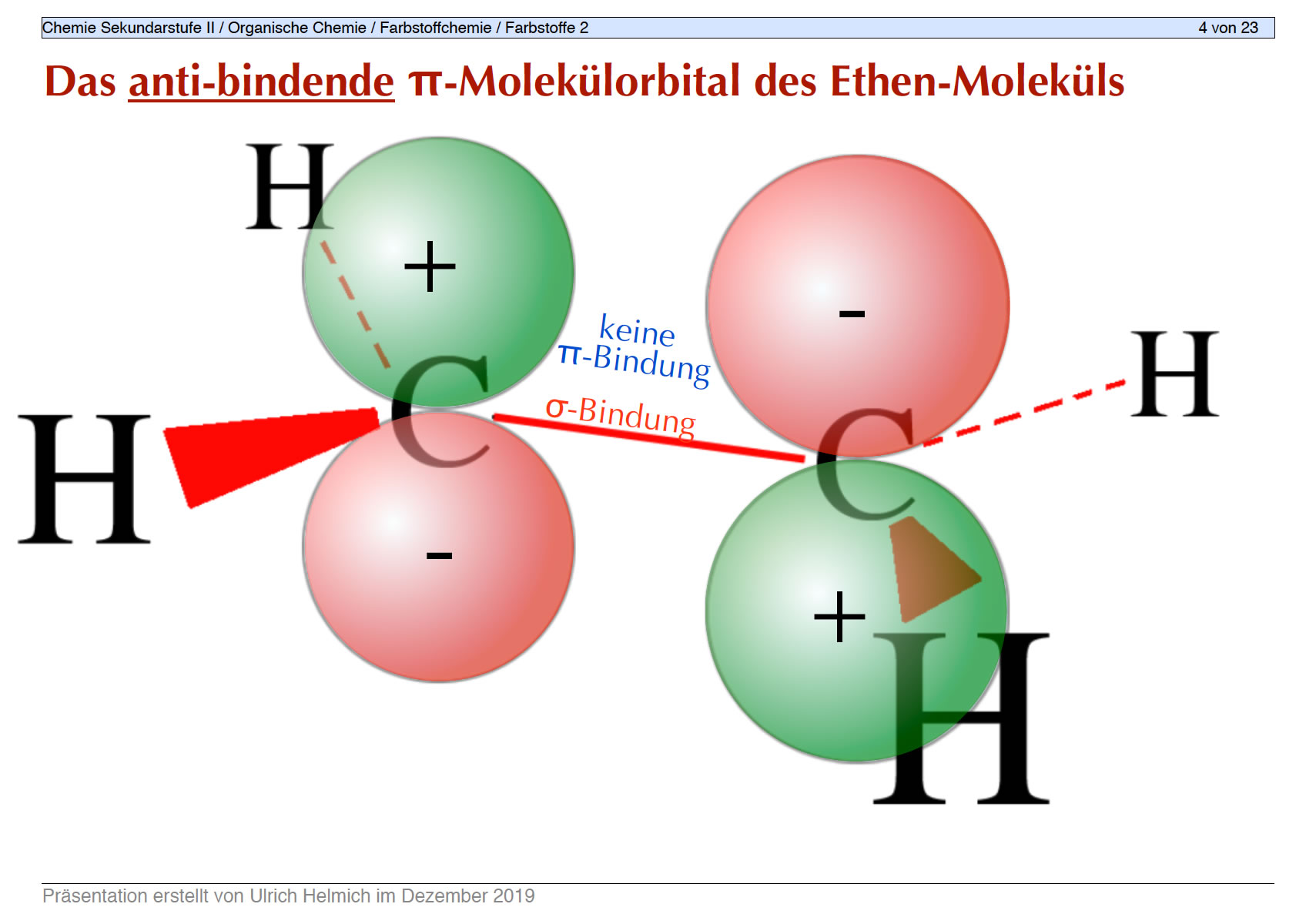
Die Folie 4
Anti-bindende MOs entstehen durch "Subtraktion" der beiden p-Orbitale des Ethen-Moleküls, wenn also beide p-Orbitale unterschiedlich ausgerichtet sind.
Auf den nächsten Folien folgend dann die üblichen Energieschemata mit den MOs von Ethen, Butadien, Hexadrien und so weiter. Man sieht, dass der Abstand zwischen dem HOMO (dem höchsten besetzten MO) und dem LUMO (dem niedrigsten unbesetzten MO) mit zunehmender Kettenlänge immer kleiner wird. Ab einer bestimmten Anzahl von konjugierten C=C-Doppelbindungen ist der HOMO-LUMO-Abstand so klein geworden, dass sichtbares Licht für einen HOMO->LUMO-Übergang ausreicht; die Verbindung erscheint jetzt farbig.
Alle 23 Folien
Die ersten sechs Folien können Sie sich zur Ansicht hier kostenlos herunterladen.