Bezüge zum Kernlehrplan und den Vorgaben 2024
Tatsächliche Schwerpunkte dieser Aufgabe
- Galvanische Elemente
- Redoxpotenziale
- Faraday-Gesetz
- Konzentrationszellen und Nernst-Gleichung (nur LK)
1. Fachspezifische Vorgaben
Zunächst werden einleitend einige wichtige Eigenschaften der Redox-Flow-Batterien vorgestellt. Diese Batterien werden vor allem als Energiespeicher für Photovoltaik- oder Windkraft-Anlagen eingesetzt. Da die bisherigen Systeme nicht sehr umweltfreundlich sind, ist man dabei, bessere Batterien zu entwickeln, die nicht auf Blei oder Lithium basieren, sondern auf Eisen.
Die Grundidee bei dieser Eisen-Redox-Flow-Batterie ist die Tatsache, dass vom Element Eisen sowohl Fe2+ wie auch Fe3+-Ionen existieren. Da die Redoxpaare
Fe / Fe2+ + 2e- (E0 = -0,44 V)
Fe2+/Fe3+ + e- (E0 = +0,77 V)
unterschiedliche Standardpotenziale E0 haben, kann man eine entsprechende Batterie konstruieren.
Ein Problem bei dieser Batterie ist die Bildung von Wasserstoffgas bei den Ladevorgängen.
M1: Versuch zur Ermittlung von E0 für Fe2+/Fe3+
Hier wird ein kleiner Versuch mit einem galvanischen Element vorgestellt, das aus einer Kupfer-Halbzelle Cu/Cu2+ und einer Eisen-Halbzelle Fe2+/Fe3+ besteht. Unter Standardbedingungen wird eine Spannung von 0,40 V gemessen.
M2: Forschungsbericht über eine Eisen-Eisen-Redox-Flow-Batterie
In einer Abbildung sieht man das Schema einer Fe/Fe-RFB. Hier eine ähnliche Abbildung, die auf einer Zeichnung aus der Masterarbeit von Irina Heitmann basiert:
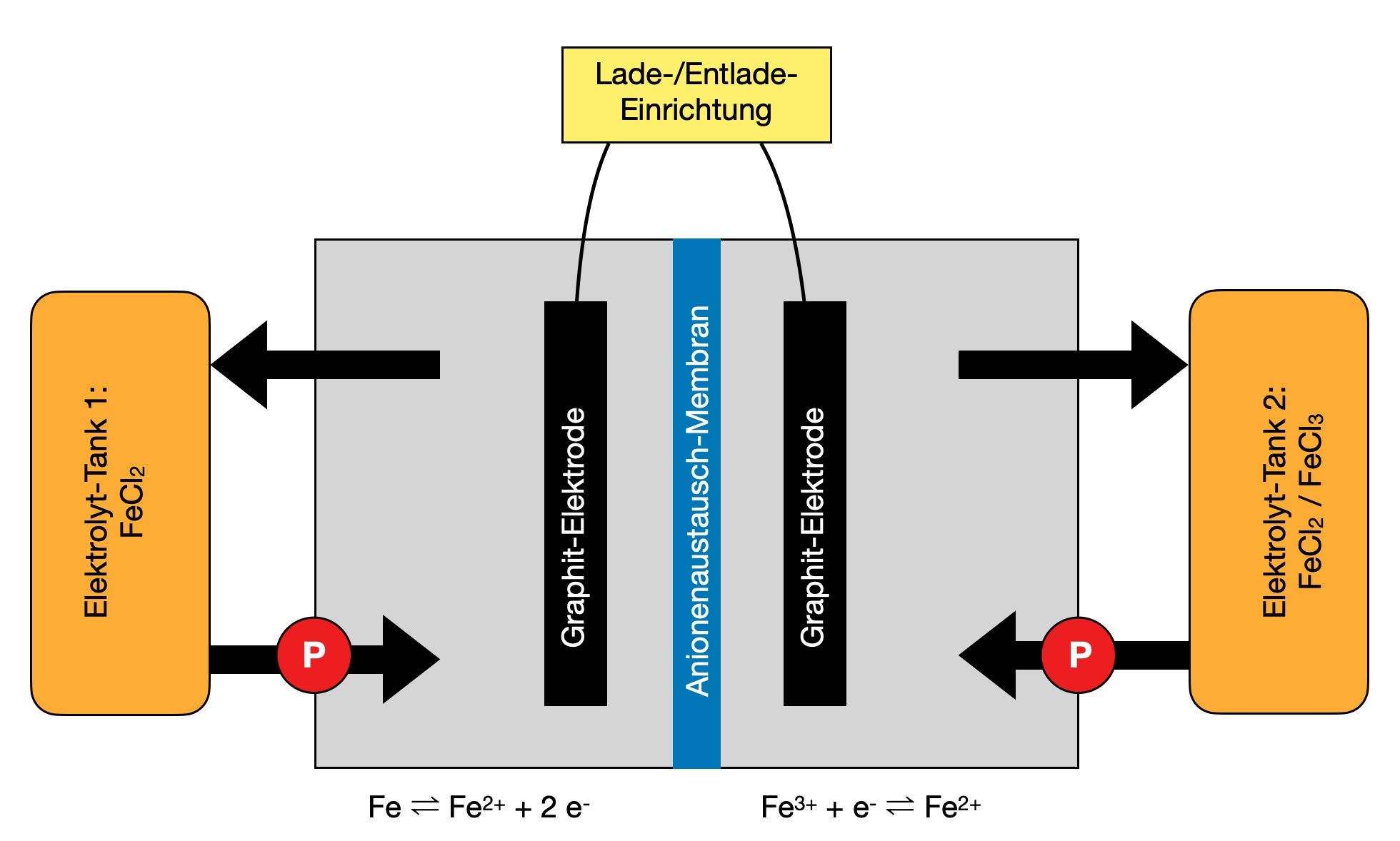
Schema einer Eisen-Eisen-Redox-Flow-Batterie
Autor: Ulrich Helmich 05/2025, Lizenz: Public domain
Dieses Bild zeigt das Schema einer solchen Eisen-Eisen-Redox-Flow-Batterie. Links sehen wir den negativen Elektrolyten-Tank, rechts den positiven.
Der negative Tank liefert die Fe2+-Ionen, die beim Aufladen zu Eisen Fe reduziert werden. Der positive Tank liefert ebenfalls Fe2+-Ionen, die beim Aufladen zu Fe3+ oxidiert werden.
Beim Entladen finden die Umkehrreaktionen statt, Eisen-Atome werden zu Fe2+-Ionen oxidiert und liefern dabei die Elektronen, Fe3+-Ionen werden zu Fe2+-Ionen reduziert und nehmen die Elektronen wieder auf.
In dem Material M2 werden die hier genannten Redoxreaktionen jedoch nicht genannt oder erläutert, dies ist Aufgabe der Schüler(innen).
Erwähnt wird in dem Material aber, dass bei jedem Ladevorgang die Batterie mit einer Ladung von Q = 3.600 C geladen wird. Beim ersten Entladen kann eine Ladung von Q = 2.268 C entnommen werden, beim zweiten und dritten Entladevorgang jeweils Q = 3.240 C.
Zusatzinformationen
- Das Faraday-Gesetz: Q = I * t = n * z * F
- Die Faraday-Konstante: F = 96.485 As/mol, 1 As = 1 C
- Molare Massen: M(Fe) = 55,85 g/mol
- Tabelle: Standardpotenziale für Fe/Fe2+, H2 + 2 H2O/2 H3O+, Cu/Cu2+, Fe2+/Fe3+
Zusatzinformationen für die LK-Aufgabe
Die gleichen Informationen 1-4 wie bei der GK-Aufgabe, zusätzlich noch die Nernst-Gleichung.
2. Aufgabenstellung Grundkurs
Aufgabe 1
- Das galvanische Element, mit dem man das Standardpotenzial von Fe2+/Fe3+ ermitteln kann, soll skizziert und beschriftet werden.
- Der Kupfer- und der Platin-Elektrode sollen die Begriffe Anode und Kathode zugeordnet werden.
- Die gemessene Spannung (also 0,4 V) soll mit dem in der Tabelle angegebenem Wert (also 0,77 V) verglichen werden.
Aufgabe 2
- Der Aufbau der Eisen-Eisen-Redox-Flow-Batterie soll beschrieben werden.
- Die Vor- und Nachteile gegenüber einem klassischen galvanischen Element sollen herausgearbeitet werden (es soll nur je 1 Vorteil und 1 Nachteil genannt werden).
- Die Prozesse an den Elektroden während des Ladens und Entladens sollen erläutert werden, natürlich unter Angabe der Redoxgleichungen.
Aufgabe 3
- Hier soll berechnet werden (Faraday-Gesetz), welche Masse Eisen sich beim im Material beschriebenen Ladevorgang abscheidet.
- Der deutliche Unterschied zwischen der Ladung C, die beim Laden eingesetzt wird, und der Ladung C, die beim ersten Entladen entnommen werden kann, soll begründet werden.
- Die Messwerte der Ladungen beim zweiten und dritten Entladevorgang sollen interpretiert werden, dabei soll auch berücksichtigt werden, dass sich beim Laden der Batterie Wasserstoffgas bildet, was aber vermieden werden soll.
3. Leistungskurs-Version
Die LK-Version der Aufgabe ist etwas umfangreicher als die GK-Version.
Materialien
M1: Vorversuch zur Ermittlung des Reaktionsverhaltens von Fe3+-Ionen gegenüber Kupfer
Versuch 1: In eine FeCl3-Lösung werden ein paar Tropfen einer Lösung von rotem Blutlaugensalz gegeben. Ergebnis: keine Blaufärbung.
Versuch 2: In eine FeCl3-Lösung wird ein Kupferblech gestellt, dieses wird ab und zu in der Lösung bewegt. Dann gibt man ein paar Tropfen der Blutlaugensalz-Lösung in die FeCl3-Lösung. Ergebnis: intensive Blaufärbung.
Wenn man das Kupferblech vor und nach dem Versuch 2 genau wiegt, kann man nach dem Versuch 2 eine Massenabnahme feststellen.
M2: Versuch zur Ermittlung von E0 für Fe2+/Fe3+
Hier wird ein kleiner Versuch mit einem galvanischen Element vorgestellt, das aus einer Kupfer-Halbzelle Cu/Cu2+ und einer Eisen-Halbzelle Fe2+/Fe3+ besteht. In der Eisenhalbzelle ist die Konzentration c(Fe3+) 1000 mal so groß wie c(Fe2+). Man kann eine Spannung von 0,62 V messen.
M3: identisch mit M2 aus der GK-Version
Aufgabenstellung
Aufgabe 1
- Die Massenabnahme des Kupferblechs soll erläutert werden.
- Die Farbveränderung der Lösung im Vorversuch 2 soll erklärt werden.
- Die Beobachtungen der Vorversuche sollen erklärt werden.