Versuch: Bromierung von Tomatensaft
Durchführung, Beobachtungen
Man füllt einen großen Standzylinder mit ca. 100 ml Tomatensaft (angewärmt) und gibt dann ca. 20 bis 30 ml Bromwasser dazu. Mit einem Glasstab rührt man die Mischung vorsichtig um und wartet einige Minuten. Mit der Zeit stellt sich eine schöne Regenbogenfärbung ein.

Das Ergebnis des Tomatensaft-Versuchs - hier die Reagenzglas-Version, die beim Entsorgen weniger Probleme macht und genau so eindrucksvoll sein kann.
Ich selbst habe den Versuch zuletzt im Jahre 2018 mit Schülern meines Chemie-GK durchgeführt. Wir wollen nun das schöne Versuchsergebnis erklären.
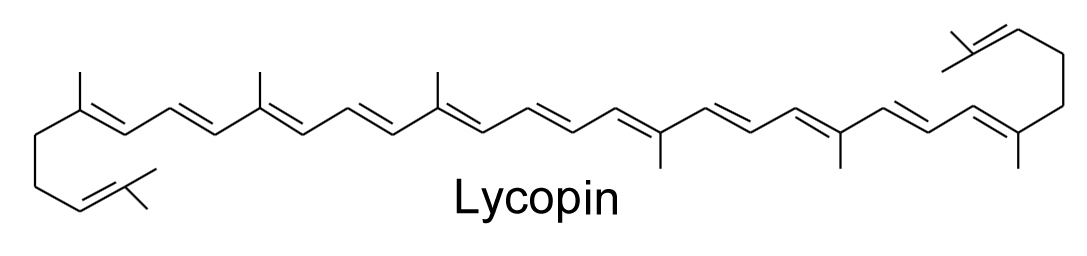
Strukturformel des Lycopins
Die rote Farbe des Tomatensaftes beruht vor allem auf den Farbstoff Lycopin, einem zur Klasse der Carotinoide gehörendem Farbstoff. Auffällig sind die 11 konjugierten Doppelbindungen im Lycopin-Molekül, diese Doppelbindungen sind verantwortlich für die Absorption von grünem Licht der Wellenlänge 460 bis 530 nm, so dass der Farbstoff dem menschlichen Auge rot erscheint. Ein Absorptionsspektrum von Lycopin kann man gut auf der Seite "Carotinoide" im Spektrum-Lexikon der Biologie sehen. Wer eine extrem ausführlich Darstellung zum Lycopin sucht, geht auf die DocMedicus-Seite.
Was passiert nun, wenn wir den Tomatensaft mit Bromwasser versetzen? Bromwasser enthält gelöstes Brom Br2. C=C-Doppelbindungen und Br2-Moleküle reagieren leicht miteinander, das haben wir beim Thema "Elektrophile Addition" schon gelernt.
Einfache Erklärung
Bei der Addition von Brom an eine C=C-Doppelbindung löst sich die Doppelbindung auf, und die pz-Orbitale verschwinden (Hybridisierungswechsel von sp2 nach sp3). Jede Doppelbindung, die sich durch die elektrophile Addition von Brom auflöst, unterbricht das System delokalisierter pi-Elektronen.
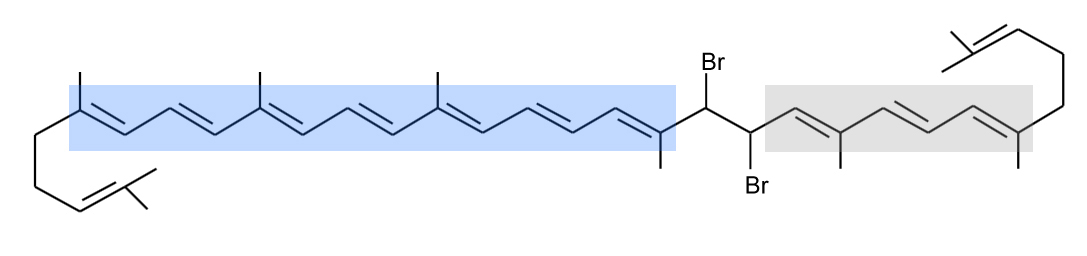
Ein Molekül des bromierten Tomatensafts
Wenn sich die beiden Brom-Atome so an das Lycopin-Molekül setzen, wie in der Abbildung oben gezeigt, dann wird das lange System delokalisierter Elektronen durch zwei kürzere ersetzt. Das linke System aus sieben konjugierten Doppelbindungen absorbiert dann zwar noch sichtbares Licht, aber Licht mit deutlich kürzerer Wellenläge, also zum Beispiel nicht mehr Grün, sondern Blau, das Auge sieht dann die Komplementärfarbe Gelb. Das rechte System mit nur noch drei Doppelbindungen absorbiert noch kürzerwelliges Licht im nicht mehr sichtbaren UV-Bereich.
Manche Lycopin-Moleküle werden auch mehrfach bromiert und sind entsprechend schwerer als einfach bromierte oder nicht-behandelte Lycopin-Moleküle. Diese Moleküle sinken im Tomatensaft nach unten und bewirken eine andere Farbe als die einfach- oder nichtbromierten Moleküle. So erklärt sich das Spektrum an Farben, das man erhält.
Komplexere Erklärung
Bei dem Tomatensaft-Versuch treten auch Grün- und Blautöne auf, das heißt, es wird langwelliges rotes und gelbes Licht absorbiert. Das Lycopin absorbiert aber das kurzwellige grüne Licht. Wenn - wie in der einfachen Erklärung - das System der delokalisierten Elektronen unterbrochen wird, können nur noch kürzere Wellenlängen absorbiert werden, aber nicht längere. Wir brauchen also eine bessere Erklärung für die Farbveränderungen.
Dazu müssen wir uns wieder den Mechanismus der elektrophile Addition näher anschauen, besonders den pi-Komplex, der sich bildet, wenn sich ein Brom-Molekül der C=C-Doppelbindung nähert. Der pi-Komplex ist in der Lage, Licht zu absorbieren (weil seine pi-Elektronen recht "locker" sitzen). Der Komplex geht dann in einen angeregten Zustand über. Zu den genauen Einzelheiten findet man im Internet kaum Informationen, aber es scheint so zu sein, dass sich die Anregung des pi-Komplexes auf das ganze Alken bzw. in unserem Fall auf das große Lycopin-Molekül auswirkt. Und zwar so, dass die Absorption des Lichtes in den langwelligeren Bereich verschoben wird.
An sich ist ein pi-Komplex extrem kurzlebig, er hat eher den Charakter eines Übergangszustandes und nicht den eines Zwischenproduktes. Nicht so in den Zellen der Tomaten. Die Lycopin-Moleküle sind in die Zellmembranen der Tomatenzellen eingebettet, und die benachbarten Lipid-Moleküle stabilisieren die pi-Komplexe. Das hat zur Folge, dass die Verschiebung der Lichtabsorption in den langwelligeren Bereich eine längere Zeit anhält.
Erklärung des Farbverlaufs
Der Farbverlauf in dem Standzylinder oder Reagenzglas ist letzten Endes auf die hohe Dichte des Bromwassers zurückzuführen. Das Bromwasser wird bei dem Versuch normalerweise oben auf den Tomatensaft aufgetragen und sinkt / diffundiert dann langsam nach unten. Dadurch entsteht eine Art Konzentrationsgradient. Die blaue Farbe ist auf die Bildung der pi-Komplexe zurückzuführen, die gelbe Farbe auf die Unterbrechung des Systems konjugierter Doppelbindungen (siehe einfache Erklärung). Grün entsteht, wo sich beide Effekte vermischen. Ist die Bromkonzentration zu gering, verändert sich die rote Farbe des Tomatensafts nicht.