Die Metalle, die wir bisher im Unterricht kennengelernt haben, geben eine bestimmte Zahl von Elektronen ab. Magnesium gibt zum Beispiel immer zwei Elektronen ab, nämlich die beiden Außenelektronen. Aluminium-Atome geben entsprechend immer drei Elektronen ab. Daher gibt es auch nur immer eine Sorte von Magnesium-Ionen, nämlich Mg2+, und auch nur eine Sorte von Aluminium-Ionen, und zwar Al3+.
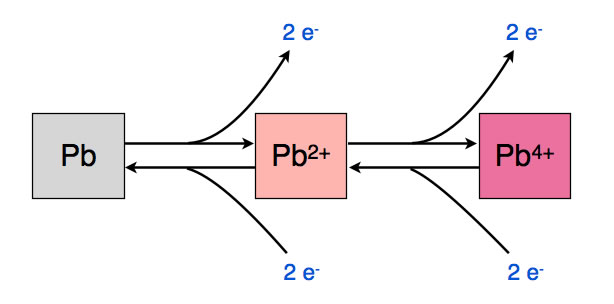
Beim Blei ist dies anders. Es gibt nämlich zwei verschiedene Blei-Ionen: das zweiwertige Pb2+ und das vierwertige Pb4+.
Offensichtlich ist das Blei in der Lage, sowohl zwei wie auch vier Elektronen abzugeben. Und zweiwertige Pb2+-Ionen können entweder zwei Elektronen aufnehmen oder zwei Elektronen abgeben:
Kommen wir jetzt zum Bleiakkumulator oder der Auto-"Batterie". Die Platten einer Autobatterie bestehen aus Bleioxid PbO, das mit Bleisulfat PbSO4 überschichtet ist.
Aufladen des Blei-Akkus
Schließt man diese Platten nun an eine Gleichstromquelle an, so geschieht folgendes (zunächst beschränken wir uns auf die Reaktionen der Blei-Ionen):
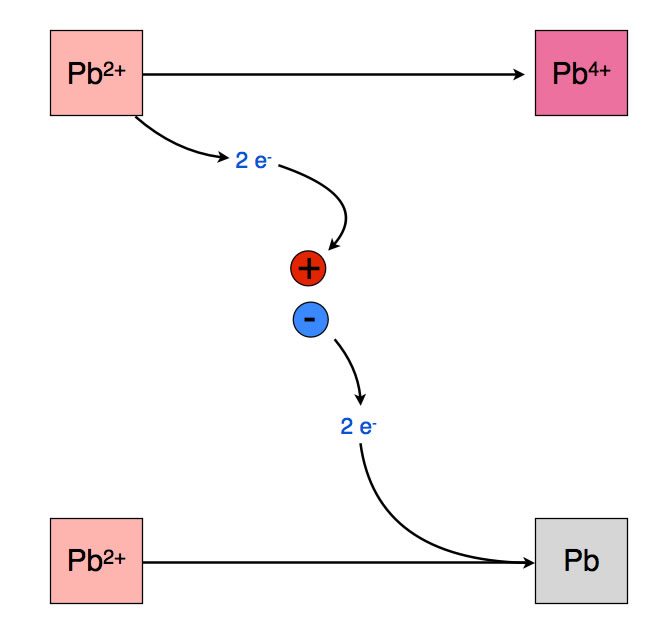
Am Pluspol herrscht Elektronenmangel. Daher läuft dort eine Reaktion ab, die Elektronen liefert, nämlich die Oxidation von Pb2+-Ionen zu Pb4+-Ionen. Am Minuspol dagegen herrscht Elektronenüberschuss. Dort läuft die Reduktion von Pb2+-Ionen zu Pb-Atomen ab. Nach einiger Zeit ist der Blei-Akkumulator aufgeladen. Er kann jetzt benutzt werden. Jedes mal, wenn ihm Strom entnommen wird, entlädt er sich ein bisschen. Wenn er ganz entladen ist, muss man ihn wieder aufladen.
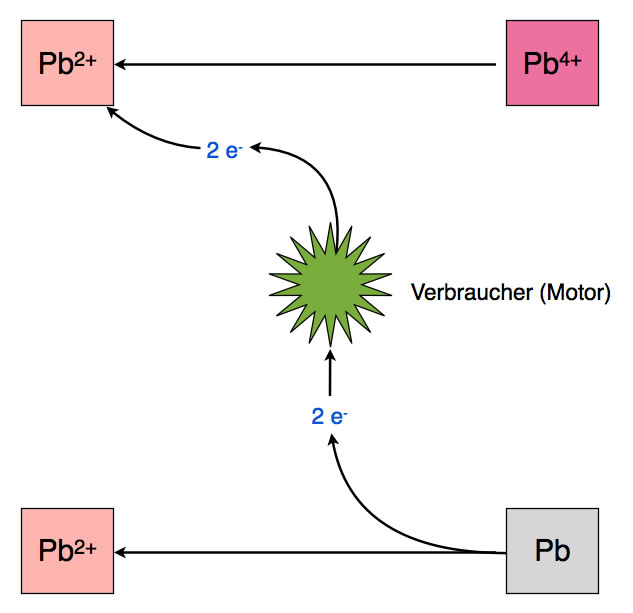
Entladen des Blei-Akkus
Beim Entladen des Blei-Akkumulators laufen die selben Vorgänge in umgekehrter Richtung ab. Der Minuspol des Blei-Akkus besteht aus Blei-Atomen, die je zwei Elektronen abgeben. Und der Pluspol enthält Pb4+-Ionen, die je zwei Elektronen aufnehmen können.
In Wirklichkeit sind die Vorgänge etwas komplizierter als hier dargestellt. Die Blei-Ionen kommen natürlich nicht isoliert vor, sondern liegen in bestimmten chemischen Verbindungen vor. Die Pb4+-Ionen in Form von Blei(IV)oxid PbO2, und die Pb2+-Ionen in Form von Bleisulfat PbSO4. Bei der Umwandlung von Bleioxid in Bleisulfat spielt die Schwefelsäure (Batteriesäure) eine entscheidende Rolle. Das folgende Schema zeigt die Vorgänge beim Aufladen des Akkus:
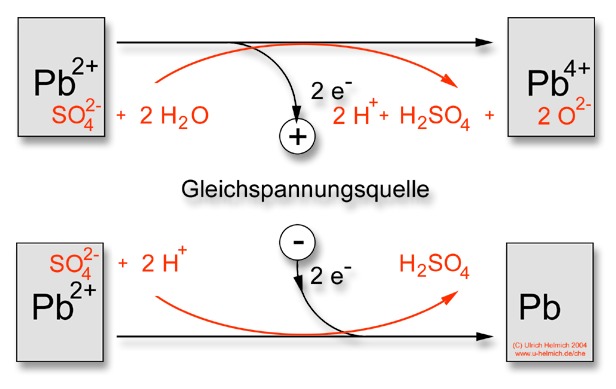
Beim Aufladen entstehen am Pluspol aus den Sulfat-Ionen und Wasser-Molekülen Oxid-Ionen und Schwefelsäure-Moleküle.
Am Minuspol entstehen aus Sulfat-Ionen und Protonen Schwefelsäure-Moleküle. Das heißt, beim Aufladen entsteht an beiden Polen Schwefelsäure.
Beim Entladen laufen die Vorgänge genau anders herum. Es wird also Schwefelsäure verbraucht, während Wasser entsteht.
Je mehr der Akku entladen ist, desto weniger Säure und desto mehr Wasser ist vorhanden. Die Dichte der Säure sinkt, was man mit einem einfachen Messgerät nachmessen kann. Ist die Säuredichte zu niedrig, so muss der Akku wieder aufgeladen werden.
Seitenanfang -
Blei -
Lithium -
Zinkoxid