Von Ulrich Helmich, Stand: 21.10.2022
Ein einfacher Versuch
Wenn die Schüler den Eisennagel-Versuch durchgeführt haben und wir die Begriffe "Reduktion", "Oxidation", "Elektronen-Donator", "Elektronen-Akzeptor", "Redoxreaktion" und "Donator-Akzeptor-Prinzip" geklärt haben, führe ich immer den umgekehrten Versuch durch: Ein Kupfernagel wird in eine Eisensulfat-Lösung gestellt. Hier passiert dann gar nichts, was bei den Schülern natürlich erst mal etwas Enttäuschung auslöst.
Dann kommt man aber relativ schnell auf die Frage: Wieso passiert hier nichts? Wieso geben die Kupfer-Atome keine Elektronen an die Eisen-Ionen ab?
Noch ein einfacher Versuch
Bevor man jetzt einen neuen Fachbegriff - hier Redoxpotenzial - einführt, sollte man erst mal versuchen, die Zusammenhänge selbst zu finden. Daher mache ich im Unterricht noch einen dritten Versuch. Diesmal wird der Kupfernagel nicht in eine Eisensulfat-Lösung gestellt, sondern in eine Silbernitrat-Lösung.
Auf dieser Seite ist der Versuch beschrieben und mehrere Photos zeigen die eindrucksvollen Ergebnisse. Kommen Sie anschließend wieder auf diese Seite zurück.
An die Ag+-Ionen geben die Cu-Atom offensichtlich bereitwillig Elektronen ab, so dass folgende Reaktion abläuft:
$2 \ Ag^{+}_{(aq)} + Cu_{(s)} \rightleftharpoons Cu^{2+}_{(aq)} + 2 \ Ag_{(s)}$
Das chemische Gleichgewicht dieser Reaktion liegt auf der rechten Seite.
Bei einer Redoxreaktion "fließen" die Elektronen vom Elektronendonator zum Elektronenakzeptor, ähnlich wie Wasser von oben nach unten fließt. Wir haben gesehen, dass Elektronen vom Eisen zum Kupfer fließen (genauer gesagt: zu den Cu2+-Ionen), und das Elektronen vom Kupfer zum Silber fließen (eigentlich zu den Ag+-Ionen). Diese Zusammenhänge kann man sich mit folgender Zeichnung veranschaulichen:
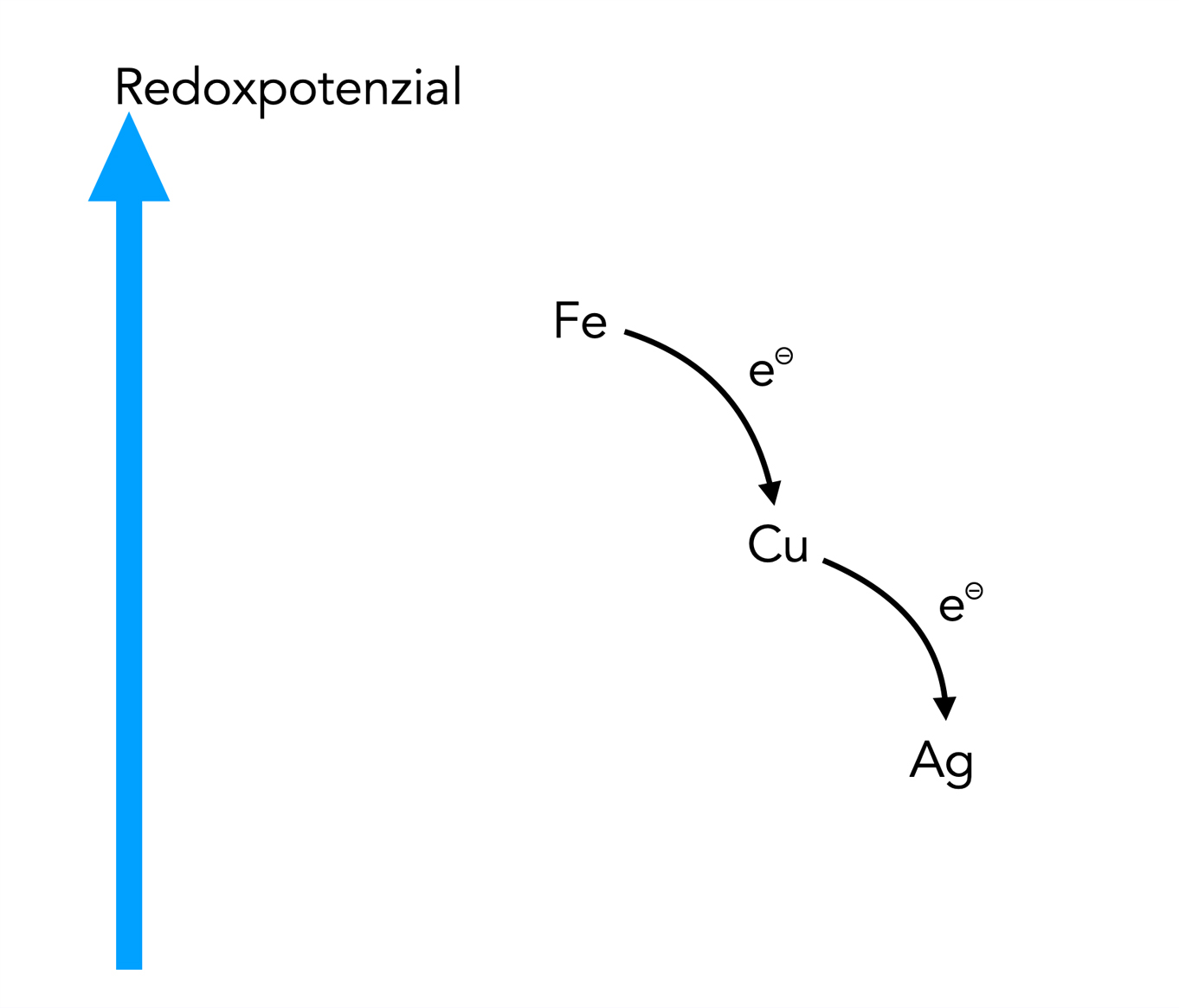
Veranschaulichung des Begriffs "Redoxpotenzial"
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Vom Eisen Fe(s) zum Kupfer Cu2+(aq) fließen die Elektronen sozusagen bergab. Das geschieht freiwillig und ohne Zufuhr von Energie. Im Gegenteil, man könnte Energie aus diesem Vorgang gewinnen, bei Batterien und Akkumulatoren wird das sogar gemacht. Und vom Kupfer Cu(s) zum Silber Ag+(aq) fließen die Elektronen ebenfalls freiwillig bergab und können dabei Arbeit verrichten, ähnlich wie bergab fließendes Wasser eine Mühle antreiben kann.
Vom Silber zum Kupfer oder vom Kupfer zum Eisen müssten die Elektronen bergauf fließen. Das ginge nur unter Einsatz von Energie. Wenn man Wasser bergauf transportieren will, muss man ja auch Pumpen einsetzen, die Energie benötigen.
Ach so - für die senkrechte Achse brauchen wir ja noch eine vernünftige Einheit. Das wäre dann das Redoxpotenzial, gemessen in Volt oder Millivolt. Wir wollen diesen wichtigen Begriff erst einmal etwas provisorisch definieren:
Redoxpotenzial
Die Neigung eines Elektronen-Donators, Elektronen an einen Elektronen-Akzeptor abzugeben.
Ein weiterer Versuch
Auf dieser Seite wird der Versuch zur Redoxreihe der Metalle besprochen, bei dem fünf verschiedene Metalle in fünf Salzlösungen eingetaucht werden. Als Ergebnis erhält man die relativen Redoxpotenziale der fünf Metalle.
Auswertung
Stellen wir die Ergebnisse des Versuchs graphisch dar:
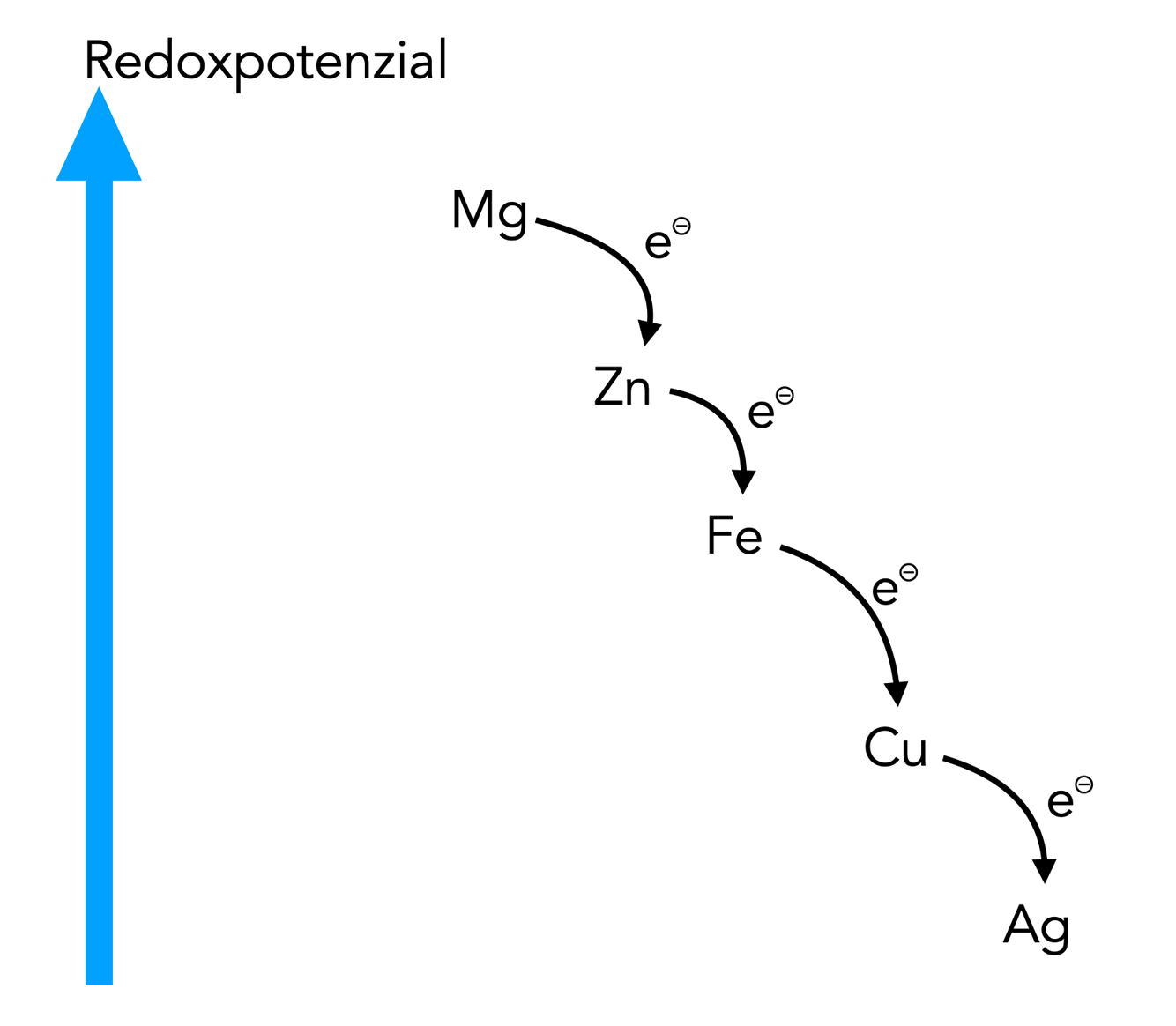
Die Redoxpotenziale der fünf Metalle aus dem Versuch
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Hier sieht man sehr schön die Redoxreihe der Metalle, allerdings sind nur die fünf Metalle berücksichtigt worden, die bei dem Versuch verwendet wurden. Es gibt viele andere Metalle, die ebenfalls in die Redoxreihe eingeordnet werden müssten. Gold zum Beispiel ist noch edler als Silber, müsste also noch weiter unten stehen. Natrium dagegen ist noch unedler als Magnesium, müsste also noch weiter oben stehen.
Wer sich die Zeichnung ganz genau anschaut, findet noch zwei - "Fehler" will ich jetzt nicht sagen, aber "Verbesserungsmöglichkeiten" wäre der richtige Ausdruck.
Erste Verbesserungsmöglichkeit
Mg-Atome geben keine Elektronen an Zink-Atome ab, sondern an Zn2+-Ionen. Genauso verhält es sich mit den anderen Atomen. Wie könnte man dies in der Graphik berücksichtigen?
Erinnern Sie sich an die Säure/Base-Paare aus der Säure/Base-Chemie? Wenn die Säure HCl ein Proton abgibt, entsteht die korrespondierende Base Cl-, man schreibt dieses Säure/Base-Paar daher als HCl/Cl-.
Analog kann man bei Redoxreaktionen verfahren. Wenn ein Zn-Atom zwei Elektronen abgibt, entsteht ein Zn2+-Ion. Dieses Ion ist in der Lage, Elektronen von einem anderen Elektronen-Donator aufzunehmen, beispielsweise von einem noch unedleren Metall wie Magnesium. Statt der Atome wie Mg, Zn etc. könnte man also die Redoxpaare Mg/Mg2+, Zn/Zn2+ etc. hinschreiben:
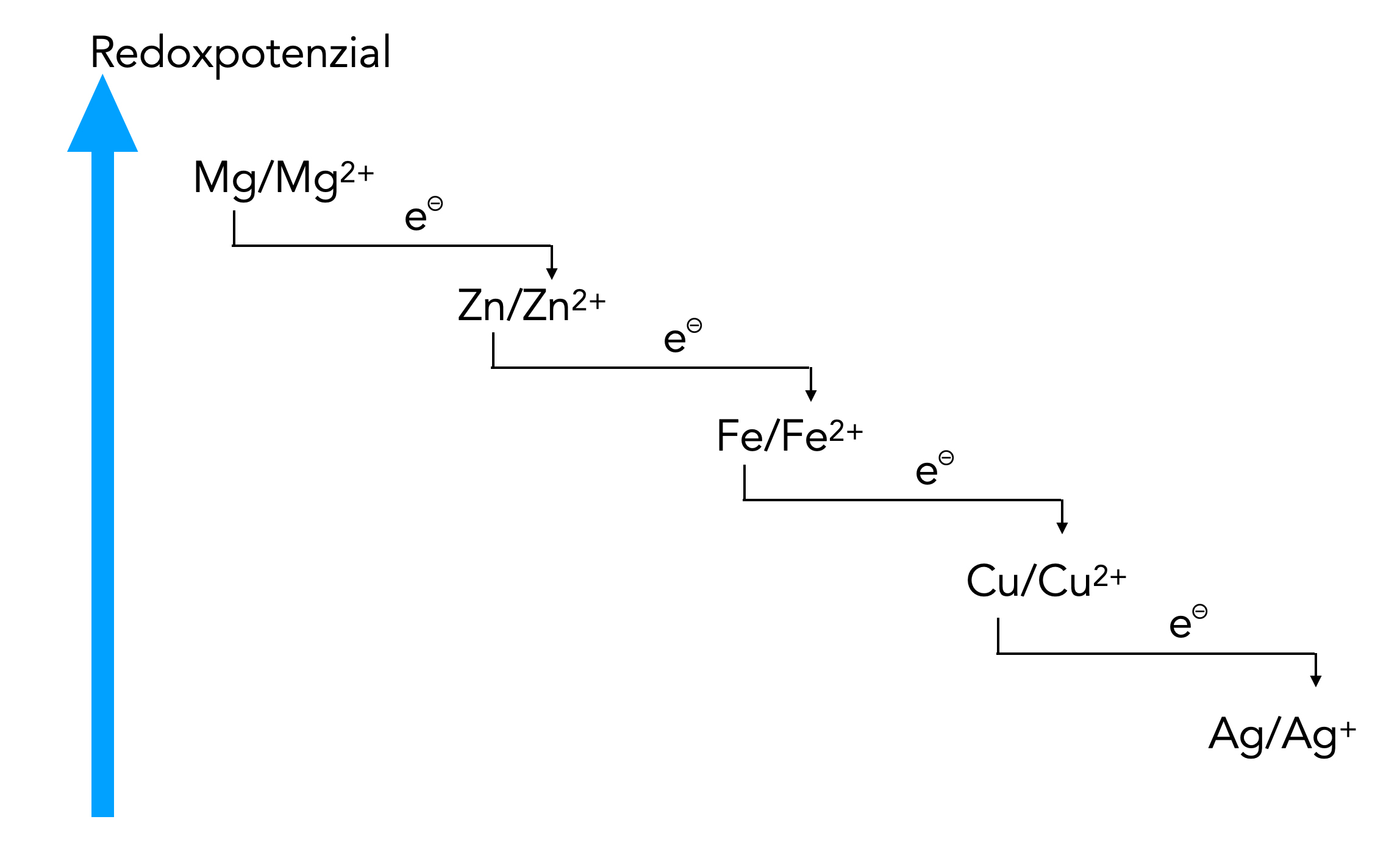
Eine verbesserte Darstellung
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bei dieser verbesserten Darstellung sieht man genau, dass die Elektronen vom Mg zum Zn2+ fließen und nicht zum Zn.
Zweite Verbesserungsmöglichkeit
Es ist immer nur jeweils ein Elektron eingezeichnet. Vom Mg zum Zn2+ etc. fließen aber immer zwei Elektronen, auch auch Cu gibt zwei Elektronen ab, allerdings an zwei Ag+-Ionen. Diese Fakten sind in der Zeichnung noch nicht berücksichtigt worden.
Dritte Verbesserungsmöglichkeit
Die Redoxpotenzial-Differenzen zwischen den Redoxpaaren sind hier immer gleich groß. Das kann stimmen, muss aber nicht. Außerdem hatten wir weiter oben gesagt, dass das Redoxpotenzial in Volt oder Millivolt angegeben wird. Davon findet sich auf dieser Graphik aber noch gar nichts.
Wir haben also noch Einiges zu tun! Aber damit beschäftigen wir uns im nächsten Abschnitt der Elektrochemie.
Wer schon jetzt noch mehr Einzelheiten zum Thema Redoxpotenzial wissen möchte, schaut sich die Lexikonseite an.