Sie sollen auf dieser Seite eine Methode kennen lernen, mit der man eine Säure-Base-Titration im Prinzip automatisieren kann. In der Schule werden wir die komplette Automatisierung nicht erreichen können, aber das Grundprinzip wird Ihnen deutlich gemacht.
Zunächst schauen wir uns einen Demonstrationsversuch an, eine so genannte Leitfähigkeitstitration. Der Verlauf der Neutralisation wird nicht über Indikator oder pH-Meter verfolgt, sondern über die elektrische Leitfähigkeit der Lösung.
Versuch 10
Leitfähigkeitstitration
Durchführung:
Es wird eine normale Titrationsapparatur aufgebaut (Becherglas (500 ml) auf Magnetrührer, Bürette (50 ml) etc.), zusätzlich wird ständig die elektrische Leitfähigkeit in dem Becherglas gemessen (Elektroden, Amperemeter, Wechselstromquelle, Voltmeter).
In das Becherglas werden 25 ml 1-molare Natronlauge gegeben, und die Bürette wird mit 50 ml 1-molarer Salzsäure befüllt. Anschließend wird eine beliebige Menge dest. Wasser in das Becherglas gegeben, damit die Elektroden der Leitfähigkeits-Messapparatur mit genügend Flüssigkeit bedeckt sind und der Rührfisch nicht "auf dem Trockenen" liegt. Außerdem gibt man ein paar Tropfen Universalindikator in das Becherglas, damit man den Verlauf der Titration auch optisch verfolgen kann.
Die Salzsäure wird nun in Portionen von je 5 ml in das Becherglas gegeben.
Nachdem 10 bis 20 Sekunden gerührt wurde, wird die Spannung sowie die Stromstärke abgelesen und daraus die jeweilige Leitfähigkeit in Ampere/Volt berechnet.
Am Ende des Versuchs wird die berechnete Leitfähigkeit gegen das verbrauchte Volumen V(HCl) aufgetragen.
Beobachtungen:
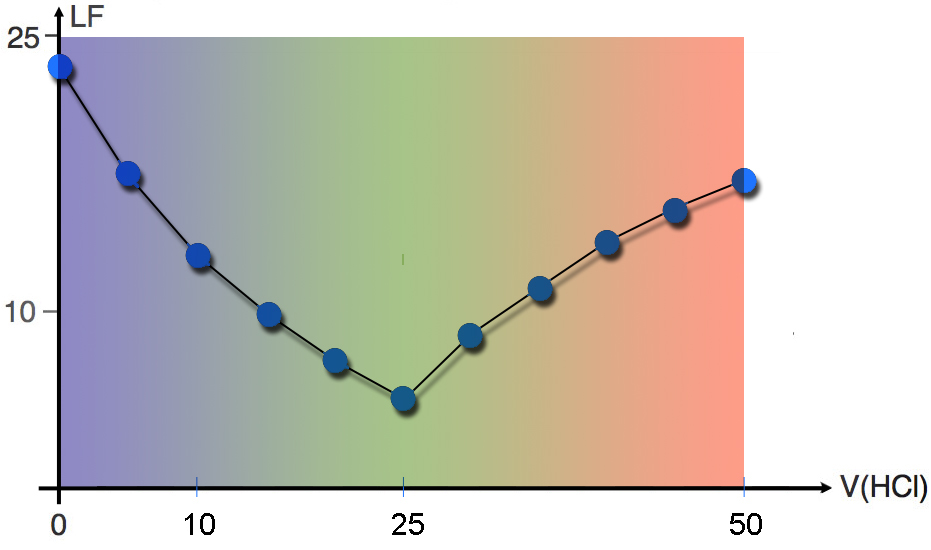
Während der HCl-Zugabe nimmt die Leitfähigkeit im Becherglas zunächst stetig ab, bis nach ca. 25 ml ein Tiefpunkt erreicht ist. Zu dieser Zeit kann man auch einen Farbumschlag des Indikators von Blau nach Grün beobachten, offensichtlich ist hier der Äquivalenzpunkt der Titration erreicht. Bei weiterer HCl-Zugabe färbt sich der Indikator rot, und die elektrische Leitfähigkeit steigt kontinuierlich zunächst stark, dann immer schwächer an.