Drei Säuren im Vergleich
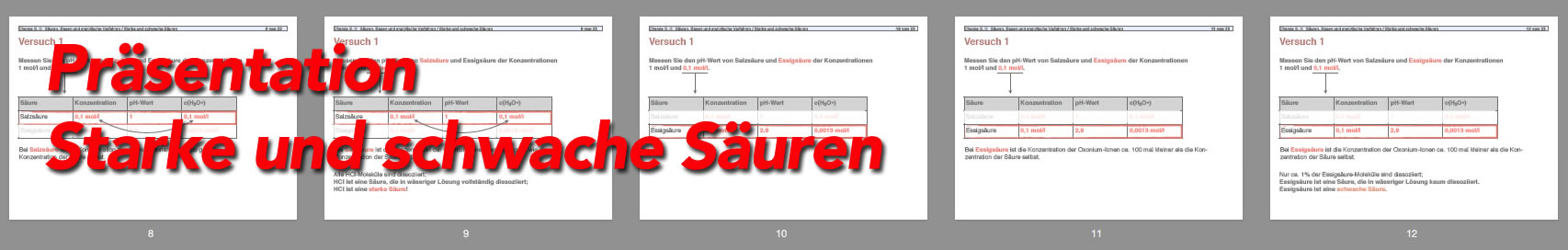
Wir machen jetzt mal einen ganz einfachen Versuch: Wir stellen 1-molare Lösungen von Salzsäure, Phosphorsäure und Essigsäure her und messen die pH-Werte der Lösungen. Hier das Ergebnis (tatsächliche Werte, nicht aus der Literatur abgeschrieben):
- Salzsäure: pH = 0,13
- Essigsäure: pH = 2,42
- Phosphorsäure: pH = 1,14
Man sollte doch denken, dass drei verschiedene Säuren mit der gleichen Konzentration auch den gleichen pH-Wert haben. Wie sind diese überraschenden Ergebnisse zu erklären?
Machen wir uns noch einmal klar, was man eigentlich unter dem pH-Wert versteht:
Der pH-Wert ist ein Maß für die Konzentration der Oxonium-Ionen in einer wässrigen Lösung. Je niedriger der pH-Wert, desto höher c(H3O+).
Offensichtlich ist c(H3O+) in der Salzsäure recht groß, in der Phosphorsäure schon deutlich kleiner, und in der Essigsäure sehr klein.
Wenn man dann bedenkt, dass der pH-Wert ein logarithmisches Maß ist, werden die Ergebnisse noch interessanter: In der Salzsäure sind ca. 10 mal so viele Oxonium-Ionen vorhanden wie in der Phosphorsäure, und in der Phosphorsäure wiederum sind ca. 10 mal so viele Oxonium-Ionen vorhanden wie in der Essigsäure.
- Salzsäure: c(H3O+) = 10-0,13 mol/l = 0,74 mol/l
- Phosphorsäure: c(H3O+) = -1,14 mol/l = 0,07 mol/l
- Essigsäure: c(H3O+) = -2,42 mol/l = 0,004 mol/l
Wenn man eine Säure in Wasser auflöst, dann dissoziiert die Säure. Ein oder zwei Protonen werden abgespalten und von Wasser-Molekülen aufgenommen, es bilden sich Säurerest-Ionen und Oxonium-Ionen.
Beispiel Salzsäure
Eine 1-molare Salzsäure hat normalerweise einen pH-Wert von 0. Bei der im Schülerversuch durchgeführten Messung wurde ein pH-Wert von 0,13 gemessen, was keine besonders große Abweichung darstellt. Wir stellen jetzt mal folgende Überlegung auf:
- Konzentration c(HCl) in der 1-molaren Salzsäure ursprünglich: 1,00 mol/l
- Konzentration c(H3O+) in der 1-molaren Salzsäure bei der Messung: 1,00 mol/l (im Idealfall) bzw. 0,74 mol/l bei dem Schülerversuch.
Schlussfolgerung:
Der Chlorwasserstoff HCl dissoziiert in Wasser zu fast 100 Prozent!
Beispiel Phosphorsäure
Die gleiche Überlegung für die Phosphorsäure sieht so aus:
- Konzentration c(HCl) in der 1-molaren Phosphorsäure ursprünglich: 1,00 mol/l
- Konzentration c(H3O+) in der 1-molaren Phosphorsäure bei der Messung: 0,07 mol/l bei dem Schülerversuch, und im Idealfall 0,1 mol/l.
Schlussfolgerung:
Die Phosphorsäure H3PO4 dissoziiert in Wasser zu ca. 10 Prozent. Von 100 Phosphorsäure-Molekülen spaltet also nur jedes zehnte ein Proton ab.
Beispiel Essigsäure
Wenn wir ähnliche Überlegungen für die Essigsäure aufstellen, kommen wir zu der
Schlussfolgerung:
Die Essigsäure CH3COOH dissoziiert in Wasser zu ca. 1 Prozent. Von 100 Essigsäure-Molekülen spaltet somit nur jedes hundertste ein Proton ab.
Der Begriff der Säurestärke
Säuren wie Salzsäure, die in wässriger Lösung (nahezu) vollständig dissoziieren, werden als starke Säuren bezeichnet. Säuren wie Essigsäure, die nur zu 1% oder weniger dissoziieren, nennt man schwache Säuren.
In der chemischen Fachliteratur differenziert man den Begriff der Säurestärke etwas feiner. Da gibt es dann sehr starke, starke, mittelstarke, schwache und sehr schwache Säuren.
- sehr starke Säuren: HCl, H2SO4 u.a.
- starke Säuren: H3PO4, HCOOH u.a.
- mittelstarke Säuren: CH3COOH, H22CO3 u.a.
- schwache Säuren: HCN, H2O u.a.
- sehr schwache Säuren: CH3-CH2-OH, NH3 u.a.
Die Salzsäure gehört also zu den sehr starken Säuren (Dissoziation zu ca. 100%), die Phosphorsäure zu den starken Säuren (Dissoziation zu ca. 10%), und die Essigsäure zu den mittelstarken Säuren (Dissoziation zu ca. 1%).
Diese Einteilung der Säuren mag vielleicht für den Alltag reichen, für einen Chemiker sind diese fünf Kategorien allerdings immer noch nicht genau genug. Auf der nächsten Seite werden wir ein Verfahren kennenlernen, wie man die Säurestärke exakt festlegen kann.