Indikatoren
Indikator-Gleichgewicht
Indikatoren sind organische Verbindungen, die normalerweise in zwei verschiedenen Strukturen mit deutlich unterschiedlichen Farben vorkommen.
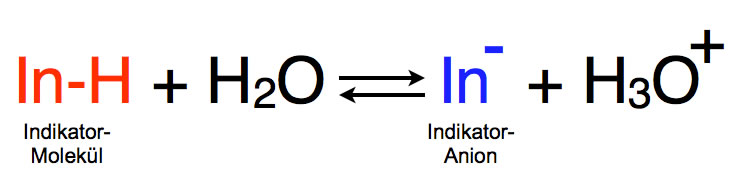
In der Regel ist der Indikator eine farbige Säure. Der Säurerest des Indikators, das Indikator-Anion In-, hat dann eine andere Farbe als das Indikator-Molekül InH.
Indikator-Molekül InH und Indikator-Anion In- stehen im Gleichgewicht miteinander. Nach dem Prinzip des kleinsten Zwanges können Gleichgewichte verschoben werden. Dazu reicht zum Beispiel eine Änderung der Konzentrationen der Edukte oder der Produkte.
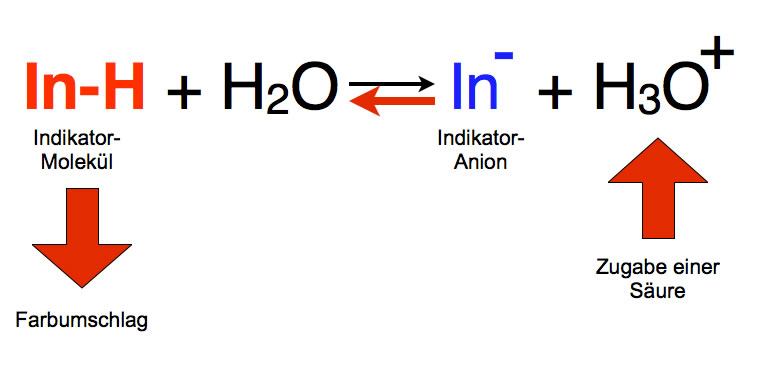
Zugabe einer Säure
Wenn man eine Lackmus-Lösung mit Salzsäure versetzt, erhöht sich die Konzentration der Oxonium-Ionen. Nach dem Prinzip des kleinsten Zwangs "reagiert" das chemische Gleichgewicht dann durch "Ausweichen" auf die Edukt-Seite. Die Konzentration der Indikator-Moleküle wird also größer, während die Konzentration der Indikator-Anionen abnimmt. Die Farbe der Lösung ändert sich im Falle von Lackmus dann nach Rot:
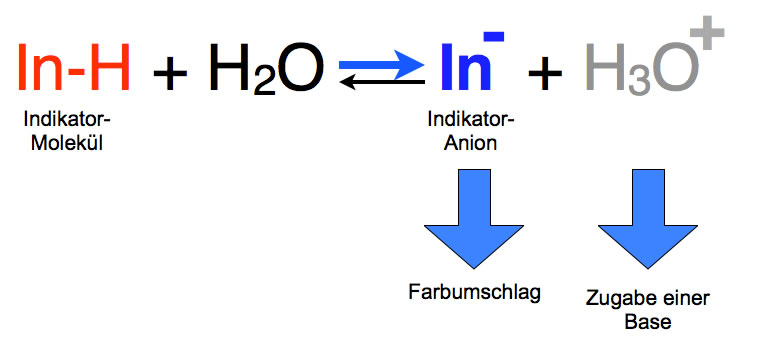
Zugabe einer Lauge
Gießt man umgekehrt eine Lauge in die Indikator-Lösung, so fügt man Hydroxid-Ionen hinzu. Diese reagieren mit den Oxonium-Ionen der Lösung zu Wasser, so dass die Konzentration der Oxonium-Ionen sinkt. Das Gleichgewicht verschiebt sich also nach rechts, und die Konzentration der Indikator-Anionen steigt. Die Lösung, die vorher rot war, schlägt nach blau um:
Umschlagbereiche
Nicht alle Indikatoren wechseln ihre Farbe bei einem pH-Wert von 7, Thymolblau beispielsweise ist bei pH-Werten < 2 rot, bei pH-Werten > 2 dagegen gelb; der Umschlagpunkt liegt also im stark sauren Bereich. Phenolphthalein ist bei pH < 8,2 farblos, bei pH > 8,2 dagegen violett. Lackmus schließlich ist ein Indikator, der seinen Umschlagbereich bei pH = 7 hat. Im sauren Bereich ist Lackmus rot, im alkalischen blau.
Was genau mit den Farbstoff-Molekülen passiert, wenn die Farbe umschlägt, kann ich Ihnen hier leider noch nicht erklären, dazu müssten Sie erst das Orbitalmodell des Atoms kennen und wissen, was der Unterschied zwischen sp2- und sp3-hybridisierten C-Atomen ist. Ich habe gerade mit Entsetzen festgestellt, dass meine Farbstoffchemie-Seiten völlig veraltet und unvollständig sind, sonst hätte ich hier auf die entsprechende Seite verlinkt.
Universalindikatoren
Wie bereits gesagt, hat ein "ordentlicher" Indikator nur zwei Zustandsformen (Ausnahmen bestätigen die Regel), die in zwei verschiedenen Farben erscheinen. Wie kommen nun die vielen verschiedenen Farben des Universalindikators oder des Rotkohlsaftes zustande? Ganz einfach: Beide Substanzen sind Gemische aus verschiedenen Farbstoffen mit verschiedenen Umschlagbereichen. Laut Wikipedia (Stichwort "Universalindikator" vom 15. August 2014) kann man einen Universalindikator durch Mischung unterschiedlicher Mengen von Thymolblau, Bromthymolblau, Methylrot und Phenolphthalein herstellen.
Auf der Seite "Cynidin" der Wikipedia findet sich eine sehr schöne Übersicht über "pH-Wert-bedingte Reaktionen der Anthocyanidine, die die Farbumschläge hervorrufen" sowie ein Photo von neun Reagenzgläsern mit Rotkohlsaft bei verschiedenen pH-Werten.
Das bringt mich auf eine gute Idee für den kommenden Chemiekurs: Man müsste eigentlich mal Rotkohlsaft und auch Universalindikator chromatographieren. Mal sehen, wie viele Farbstoffe man auf diese Weise erkennt.