Ammoniumchlorid als saures Salz
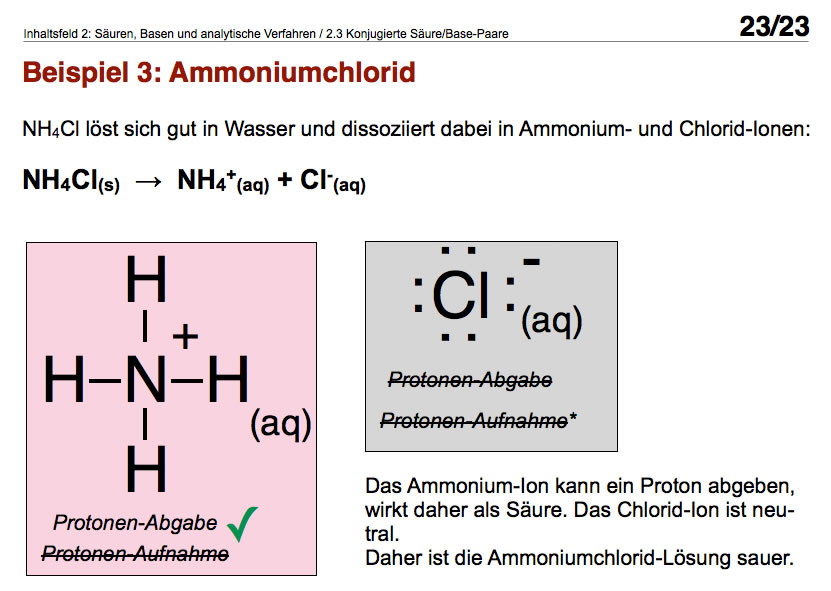
Hier sehen Sie Bild 23 aus meiner Präsentation "Korrespondierende Säure/Base-Paare".
Methodisches Vorgehen
Die grundlegende methodische Idee, die jedem Schüler sofort einleuchtet, ist folgende:
Eine Säure gibt Protonen ab. Damit ein Teilchen also eine Säure sein kann, muss sie Wasserstoff-Atome besitzen, die zudem mit einer polaren kovalenten Bindung an ein anderes Atom gebunden sind.
Eine Base nimmt Protonen auf. Dazu muss das Teilchen ein freies Elektronenpaar besitzen und außerdem eine recht hohe Elektronegativität haben.
Unter diesen beiden Aspekten werden nun die beiden Komponenten des Salzes untersucht. Ist das Kation eine Säure oder eine Base? Ist das Anion eine Säure oder eine Base? Danach entscheidet sich dann, ob das Salz mit Wasser eine neutrale, saure oder alkalische Lösung bildet.
Anwendung
- Ist NH4+ eine Säure? Ja, es ist ein H-Atom vorhanden, das polar an das N-Atom gebunden ist; außerdem ist das Ion positiv geladen, was die Abgabe eines positiven Protons begünstigt.
- Ist NH4+eine Base? Nein, es ist kein freies Elektronenpaar mehr vorhanden.
- Ist Cl- eine Säure? Nein, es ist kein H-Atom vorhanden.
- Ist Cl- eine Base? Ja, aber H2O-Moleküle geben keine Protonen an Cl- ab.
Man kann also zusammenfassen: Das NH4+-Ion ist sauer, und das Cl--Ion reagiert neutral, also entsteht eine saure Lösung, wenn man Ammoniumchlorid in Wasser löst.
Der pH-Wert einer 0,1-molaren Lösung von Ammoniumchlorid liegt übrigens bei 5,1.