Modifikationen
Das Element Kohlenstoff ist kein normales Element wie Natrium oder Chlor, sondern kommt in mehreren Modifikationen vor. Das Wort "Modifikation" kann man hier am besten mit "Erscheinungsform" übersetzen.
Was sagt das schlaue Römpp Chemie-Lexion dazu?
"Modifikation. Bezeichnung für Zustandsformen von Elementen und Verbindungen, die sich in der chemischen Zusammensetzung... nicht unterscheiden, jedoch in den physikalischen Eigenschaften". [1]Solche Modifikationen gibt es nicht nur beim Kohlenstoff, sondern auch bei anderen Elementen wie Schwefel oder Mangan.
Bis vor wenigen Jahrzehnten kannte man nur zwei Modifikationen des Kohlenstoffs, nämlich Graphit und Diamant. In den letzten Jahrzehnten hat man dann weitere Modifikationen entdeckt bzw. künstlich hergestellt: Fullerene und Graphen.
Detailliertere Informationen zu den Kohlenstoff-Modifikationen finden Sie auf den Lexikon-Seiten
die teilweise aber erst noch erstellt werden müssen.
Ursache für die unterschiedlichen Modifikationen sind in dem Kohlenstoff-Atom selbst zu suchen, das wird besonders beim Vergleich von Graphit und Diamant deutich.
Graphit
Im Graphit sind die C-Atome sp2-hybridisiert. Die drei sp2-Hybridorbitale bilden Winkel von 120 º aus und überlappen mit den sp2-Hybridorbitalen von drei benachbarten C-Atomen. So entstehen stabile kovalente Bindungen in einer Ebene. Die pz-Orbitale ragen nach oben und unten aus dieser Ebene heraus und überlappen schwach. Die Elektronen dieser pz-Orbitale können sich dann als "Elektronenwolke" frei in diesen pz-Orbitalen oberhalb und unterhalb der Kohlenstoff-Schicht bewegen. Dies erklärt einige Eigenschaften des Graphits.

Die hexagonale Kristallstruktur von Graphit, einmal von der Seite, einmal von oben gesehen.
Quelle: Wikipedia, Autor: DeepKing
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license.
Die Abstände zwischen den einzelnen Schichten des Graphits sind so groß, dass die pz-Orbitale der übereinander liegenden C-Atome nicht mehr überlappen können. Statt dessen werden die Schichten durch schwache van-der-Waals-Kräfte zusammengehalten.
Diamant
Im Diamant sind die C-Atome sp3-hybridisiert. Die vier sp3-Hybridorbitale bilden Winkel von 109 º aus und überlappen mit den sp3-Hybridorbitalen von vier benachbarten C-Atomen. Jedes C-Atom ist also mit vier kovalenten Bindungen mit vier weiteren C-Atomen verbunden, und diese Bindungen sind recht stark. Das erklärt u.a. die enorme Härte von Diamant.
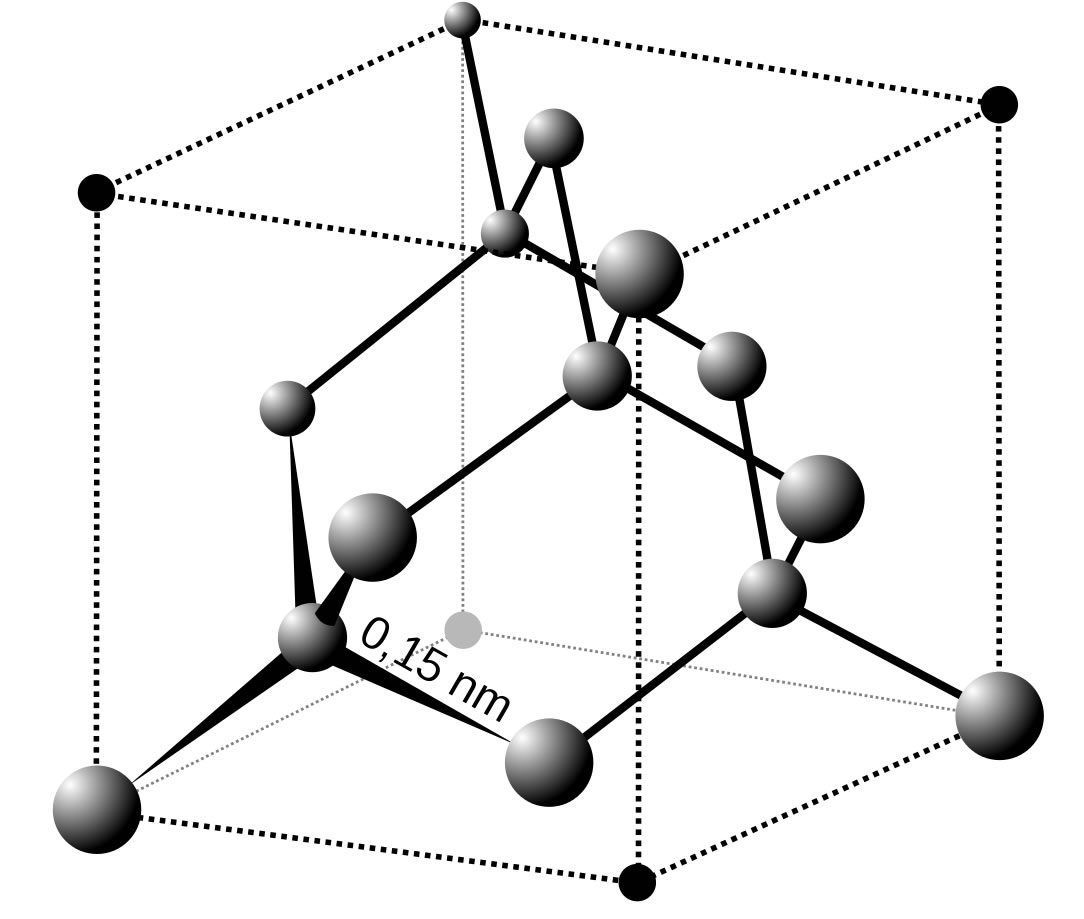
Das Diamantgitter
Quelle: Wikipedia, Artikel "Diamant". Autor: Anton. Vectorized by Magasjukur2
Diese Datei ist unter der Creative-Commons-Lizenz Attribution-ShareAlike 3.0 Unported (CC BY-SA 3.0) veröffentlicht.
Bei dieser neuen Kohlenstoff-Modifikation, die erst 1985 entdeckt wurde, sind die C-Atome sp2-hybridisiert, jedes C-Atom ist also wie beim Graphit mit drei weiteren C-Atomen verbunden. Allerdings liegen bei den Fullerenen diese C-Atome nicht in einer Ebene, sondern die Ebene ist zu einer Kugel gekrümmt.
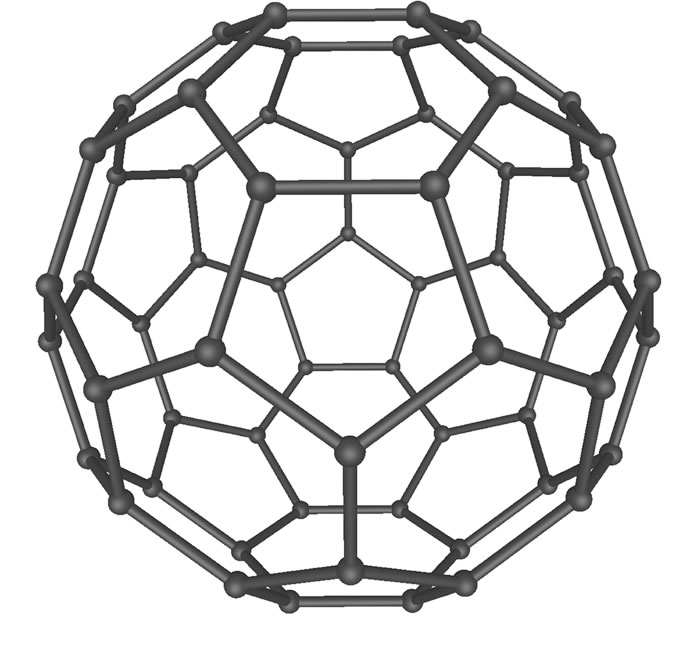
Das C60-Fulleren, aus als "Buckyball" bekannt.
Quelle: Wikipedia, Autor: Mstroeck
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license. Subject to disclaimers.
Fulleren-Moleküle werden deshalb gerne mit Fußbällen verglichen. Das bekannteste Fulleren-Molekül besteht aus genau 60 Kohlenstoff-Atomen.
Graphen
Diese Kohlenstoff-Modifikation wurde erst 2004 zum ersten Mal hergestellt. Bei Graphen (Betonung auf der letzten Silbe!) handelt es sich im Grunde um eine einzelne Graphit-Schicht.

Graphen
Quelle: Wikipedia, Autor: Jynto / CC0
This file is made available under the Creative Commons CC0 1.0 Universal Public Domain Dedication.
Die C-Atome sind also sp2-hybridisiert und mit je drei anderen C-Atomen verbunden. Auch hier überlappen die pz-Orbitale, und die delokalisierten pi-Elektronen dieser Orbitale halten sich oberhalb und unterhalb dieser Schicht auf.
Kohle
Kohle (Steinkohle, Braunkohle, Koks etc.) ist keine Modifikation des Elementes Kohlenstoffs!
Kohle enthält zwar jede Menge Kohlenstoff (in Form von Graphit), aber auch viele andere, vor allem organische Verbindungen sind in Kohle enthalten.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992