Wenn man bei der Methode 2, die auf der Hauptseite erläutert wurde, die Bewegung des Kolbens filmt und dann das Video auswertet, kann man eine Tabelle bzw. eine Graphik anfertigen, die vielleicht so aussieht:
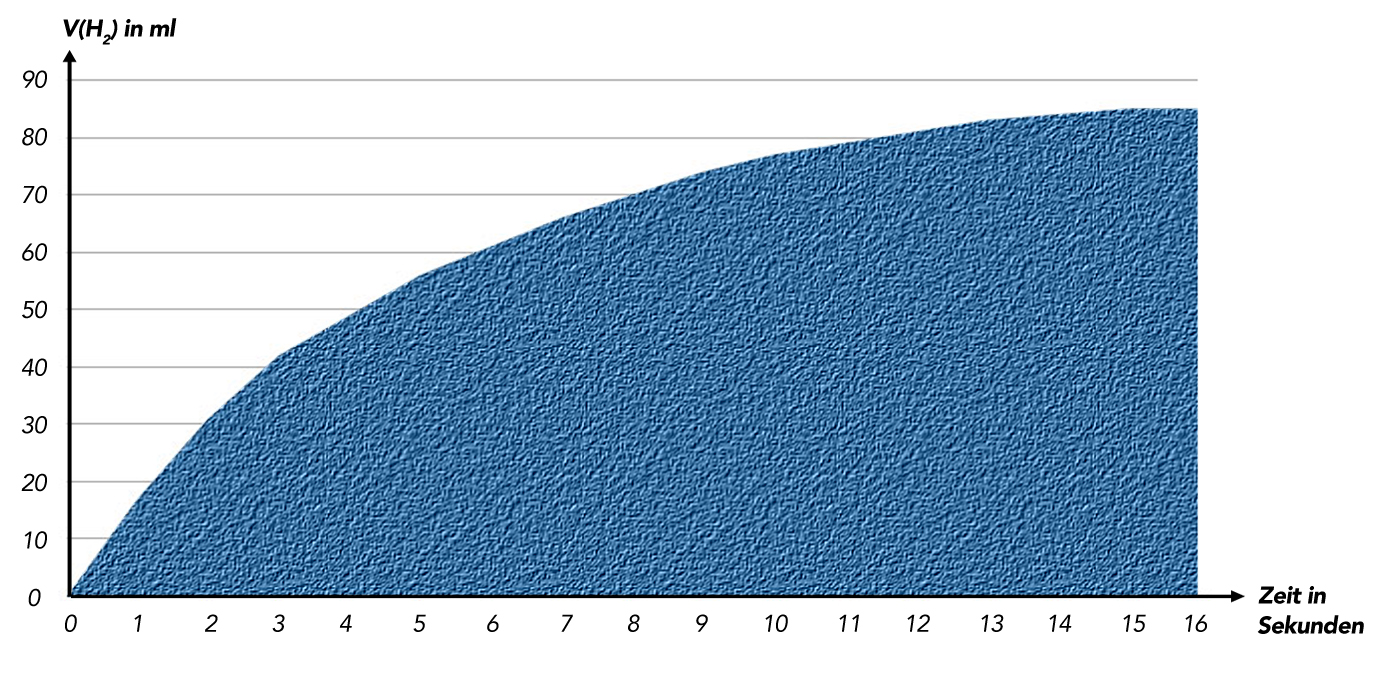
Graphische Darstellung der Zunahme von V(H2) gegen die Zeit. Waagerechte Achse: Zeit in Sekunden; senkrechte Achse: V(H2) in ml.
Im Laufe der Zeit wird pro Zeiteinheit immer weniger Wasserstoff gebildet, bis schließlich das Volumen im Kolbenprober gar nicht mehr zunimmt. Man sieht also sofort, dass die Reaktionsgeschwindigkeit als erste Ableitung der Volumenzunahme immer kleiner wird und gegen den Wert Null strebt.
Das Problem bei dieser Methode ist jetzt, wie entnimmt man der Graphik die Reaktionsgeschwindigkeit zum Zeitpunkt t und wie ermittelt man die jeweilige Konzentration der Salzsäure zum Zeitpunkt t?
Auf dieser Seite wird ausführlich erläutert, wie man eine solche Graphik auswertet.
Auswertung
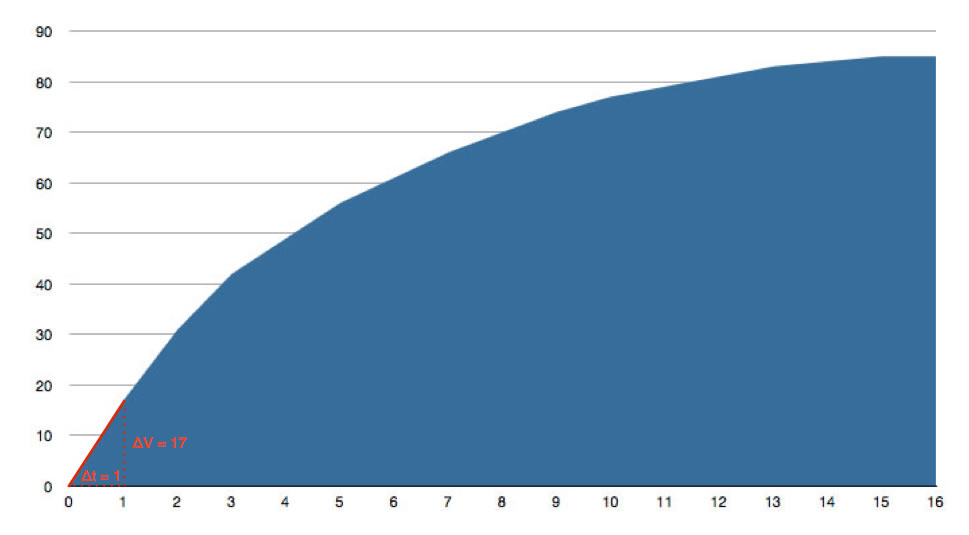
Als "Zeitraster" wählen wir hier 1 Sekunde. In der ersten Sekunde haben sich ca. 17 ml Wasserstoffgas entwickelt. Aus diesem Volumen können wir leicht die Stoffmenge n(H2) berechnen, dazu reicht ein einfacher Dreisatz aus:
Wären 22,4 ml Gas entstanden, wäre n(H2) genau 1 mmol. Nun sind aber nur 17 ml Gas entstanden, also haben sich 17/22,4 = 0,76 mmol H2 gebildet. Bei dieser Annahme gehen wir davon aus, dass Wasserstoff ein ideales Gas ist, also bei Raumtemperatur ein Molvolumen von 22,4 Liter hat.
An sich müsste man jetzt bei dieser Berechnung auch noch die Raumtemperatur und den Luftdruck berücksichtigen und dann in einer Tabelle nachschauen, wie groß das Molvolumen des Gases unter diesen Bedingungen sind. Aber da bereits unsere Messungen relativ ungenau waren, bringt ein solches "exaktes" Vorgehen im Grunde nicht viel.
Nach der Reaktionsgleichung
$2 HCl + Zn \to H_{2} + ZnCl_{2}$
werden 2 mol HCl aufgebraucht, wenn 1 mol H2 entstanden ist. In der ersten Sekunde der Messung sind also 2 * 0,76 mmol = 1,52 mmol HCl verbraucht worden. Aus diesem Wert können wir nun die Konzentration der restlichen HCl zum Zeitpunkt t = 1s berechnen.
Beispielrechnung
Im Reaktionskolben befanden sich zum Zeitpunkt t = 0 s genau 10 ml Salzsäure der Konzentration c(HCl) = 1 mol/l. Die Stoffmenge n(HCl) betrug zu diesem Zeitpunkt dann 0,01 mol bzw. 10 mmol. Nach 1s waren dann nur noch 10 - 1,52 = 8,48 mmol HCl im Reaktionskolben, was einer Konzentration von c(HCl) = 0,848 mol/l entspricht.
Wir notieren also:
Nach 1 Sekunde hatten wir bei einer HCl-Konzentration von 0,848 mol/l eine Reaktionsgeschwindigkeit von 0,76 mmol H2 pro Sekunde.
So ganz genau ist dieses Vorgehen auch nicht, denn die Konzentration von 0,848 mol/l wurde ja erst nach einer Sekunde erreicht; vorher war c(HCl) größer. Eigentlich müsste man analog zur Durchschnittsgeschwindigkeit innerhalb der ersten Sekunde auch eine Durchschnittskonzentration für diesen Zeitraum angeben.
Und so machen wir jetzt für die anderen Zeitpunkte weiter, was ganz schön aufwendig ist. Leichter wäre es gewesen, wenn wir die Messwerte in einer Tabellenkalkulation notiert hätten (Zeitpunkt und H2-Volumen). Dann könnten wir die Reaktionsgeschwindigkeit und die jeweilige HCl-Konzentration leichter ausrechnen und vor allem die Abhängigkeit der Reaktionsgeschwindigkeit von der HCl-Konzentration graphisch darstellen lassen.
Für den zweiten Zeitabschnitt rechnen wir das Ganze aber noch einmal manuell aus, also ohne Tabellenkalkulation. In dieser Sekunde haben sich ca. 13 weitere Milliliter Wasserstoffgas entwickelt, was einer Stoffmenge n(HCl) von 13/22,4 = 0,58 mmol entspricht. Die Reaktionsgeschwindigkeit in dieser Sekunde liegt also bei durchschnittlich 0,58 mol pro Sekunde.
Die HCl-Konzentration am Ende der zweiten Sekunde berechnet sich wie folgt: Insgesamt sind am Ende der zweiten Sekunde 17 + 13 = 30 ml Wasserstoffgas entstanden, das sind 1,34 mmol H2, was einem Verbrauch von 2,68 mmol HCl im Reaktionsgefäß entspricht. Diesen Wert ziehen wir von den ursprünglichen 10 mmol HCl ab und erhalten 7,32 mmol. Am Ende der zweiten Sekunde hat c(HCl) also den Wert 0,732 mol/l.
Wir notieren also:
Nach 2 Sekunden hatten wir bei einer HCl-Konzentration von 0,732 mol/l eine Reaktionsgeschwindigkeit von 0,58 mmol H2 pro Sekunde.
Einsatz der Tabellenkalkulation
Angenommen, wir hätten die Messwerte sofort in eine Tabellenkalkulation eingetragen. Dann könnte das ungefähr so aussehen:
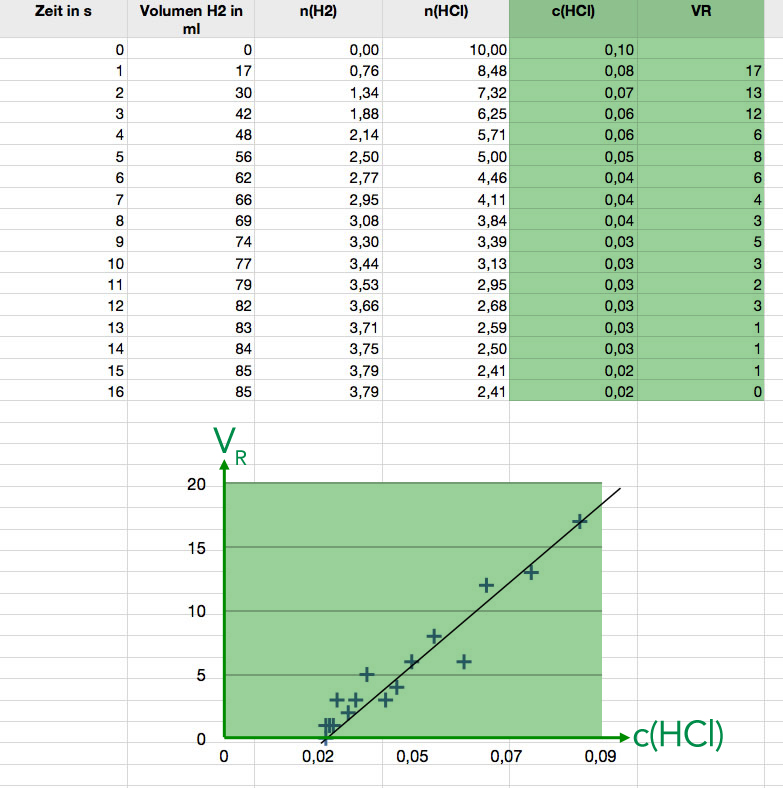
Bearbeiteter Screenshot der Tabellenkalkulation mit den gemessenen und anschließend berechneten Daten/Werten
Die beiden ersten Spalten enthalten die Messwerte, in der dritten Spalte wurde die Stoffmenge n(H2) aus dem Volumen V(H2) berechnet (Beispielrechnungen siehe oben), in der vierten Spalte wurde dann die Stoffmenge n(HCl) berechnet, in der nächsten Spalte die Konzentration c(HCl). Die Reaktionsgeschwindigkeit wurde erst in der letzten Spalte berechnet (hier einfach als Differenz VN+1 - VN). Die beiden letzten Spalten wurden dann graphisch als xy-Diagramm dargestellt. Die Ausgleichsgerade wurde dann manuell in das Diagramm gelegt.
Man sieht hier eindeutig einen (mehr oder weniger) linearen Zusammenhang zwischen v(HCl) und der Reaktionsgeschwindigkeit:
VR = k * c(HCl) - x
An sich lautet die Geschwindigkeitsgleichung für eine monomolekulare oder pseudomonomolekulare Reaktion:
VR = k * c(A)
wenn A der Ausgangsstoff ist, von dessen Konzentration die Reaktionsgeschwindigkeit abhängt. Die obige Graphik sieht etwas anders aus, an sich müsste die Gerade ihren Ursprung bei (0,0) haben. Daher der Zusatzterm -x in der ersten Gleichung. Warum das bei dem Versuch so war, kann nur spekuliert werden; Schulversuche laufen meistens nicht allzu präzise ab.