Ionengitter
Die Ionenbindung, die auf den vorhergehenden Seiten beschrieben wurde, beruht auf elektrostatischen Anziehungskräften zwischen den entgegengesetzt geladenen Ionen. Diese elektrostatischen Kräfte sind in keiner Weise gerichtet. Ein Natriumion zieht alle Chloridionen der näheren Umgebung an, und ein Chloridion wiederum zieht alle Natriumionen der näheren Umgebung an.
Wenn also während der Salzbildung die noch gasförmigen Ionen in den festen Zustand übergehen, entstehen keine einzelnen Salz-Moleküle, sondern es bildet sich ein Ionengitter.
Das Natriumchlorid-Gitter
Bei der Bildung von Natriumchlorid entsteht eine typische Gitterstruktur. Die Chlorid-Anionen sind ca. doppelt so groß wie die Natrium-Kationen, daher bestimmen sie weitgehend das Aussehen des Gitters. Sie bilden eine dichteste Kugelpackung (jedes Chlorid-Ion ist von 12 anderen umgeben). In einer solchen dichtesten Kugelpackung existieren zwei Arten von Lücken: kleine Lücken (die von je vier Kugeln umgeben sind) und große Lücken (die von je sechs Kugeln umgeben sind).
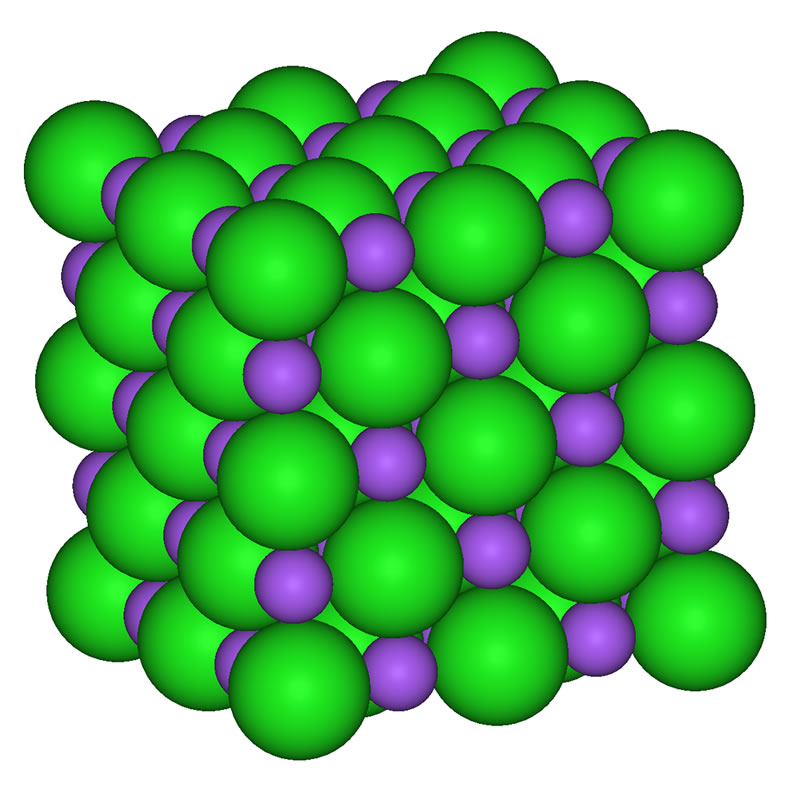
Das Natriumchlorid-Gitter (Public domain - Bild aus der Wikipedia, hochgeladen von User Benjah-bmm27)
Die Natrium-Kationen sind im Vergleich zu den Chlorid-Ionen so klein, dass sie sich nun in die großen Lücken des Chlorid-Gitters setzen können. Jedes Natriumion ist dann von sechs Chloridionen umgeben und jedes Chloridion von sechs Natriumionen.
Eine ganze Reihe von Salzen kristallisiert in einem analogen Gitter, so daß wir von einem regelrechten NaCl-Gittertyp sprechen können.
Das Zinksulfid-Gitter
Beim Zinksulfid sind die Sulfid-Anionen mehr als doppelt so groß wie die Zink-Kationen, ein NaCl-Gitter kann sich hier nicht mehr bilden, die Zink-Ionen würden in den großen Oktaeder-Lücken "wackeln", sie setzen sich in die kleinen Tetraeder-Lücken.
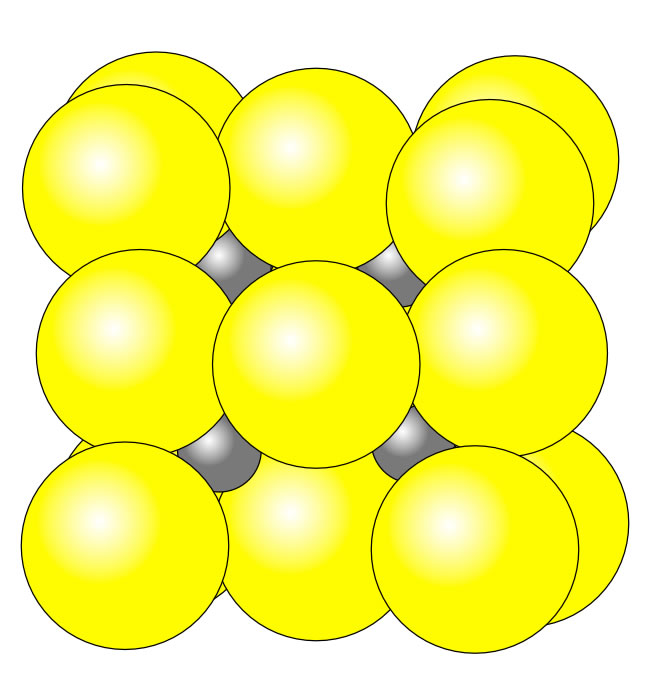
Das Zinksulfid-Gitter
Dieses Werk ist lizenziert unter einer Creative Commons Namensnennung - Nicht-kommerziell - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz. Autor: Ulrich HelmichBei diesem Gittertyp ist ein Kation also von vier Anionen umgeben, und zwar tetraederförmig. Jedes Anion seinerseits ist tetraederförmig von vier Kationen umgeben.
Da der EN-Unterschied zwischen den Zink-Ionen und den Sulfid-Ionen recht klein ist (nur 0,9), liegt eigentich gar keine richtige Ionenbindung mehr vor, sondern fast schon eine kovalente Bindung. Wenn man also das ZnS-Gitter zeichnen will, sollte man der Zeichnung nicht die Ionenradien zu Grunde legen, sondern eher die Atomradien. Interessanterweise sind bei den Atomradien die Unterschiede zwischen Zink und Schwefel lange nicht mehr so groß wie bei den Ionen; im Gegenteil, die Zink-Atome haben einen größeren Durchmesser als die Schwefel-Atome (Details hierzu siehe die Seite "Allgemeine und organische Chemie" der Universität München. Man muss allerdings lange nach unten scrollen, bis man den Punkt 12.13 erreicht hat).
Das Cäsiumchlorid-Gitter
Wenn Kationen und Anionen ungefähr gleich groß sind, so entsteht ein Kristallgitter vom Typ des Cäsiumchlorids.
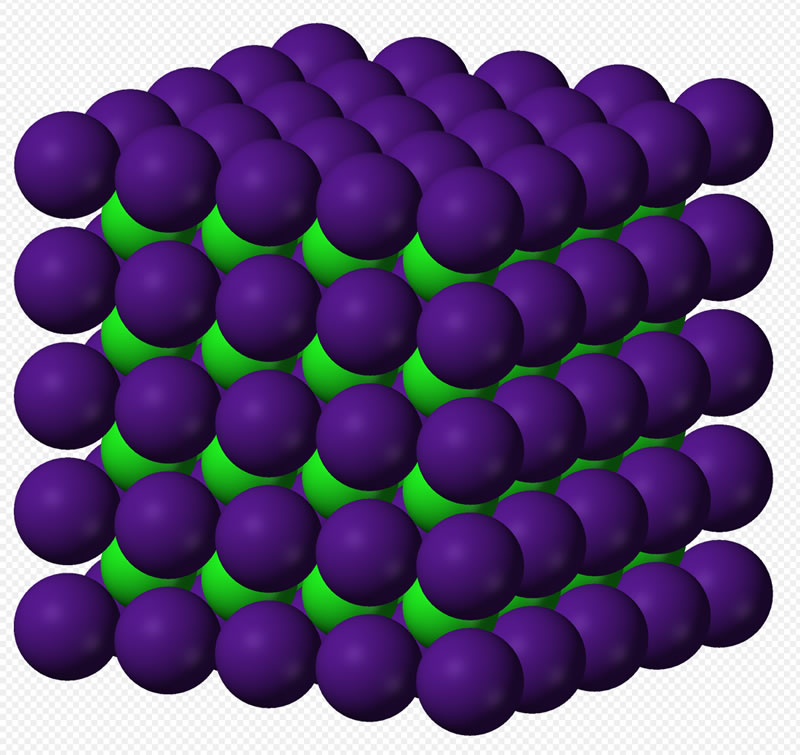
Das Cäsiumchlorid-Gitter (Public domain - Bild aus der Wikipedia, hochgeladen von User Benjah-bmm27)
Hier ist jedes Kation von genau 8 Anionen und jedes Anion von 8 Kationen umgeben.
Seitenanfang -
Versuch -
Erste Deutung -
Ionenbindung -
Energieaspekte -
Schmelzpunkte -
Kristallstrukturen