Conotoxine sind eine Gruppe von Nervengiften, die von tropischen und subtropischen Kegelschnecken produziert werden.
Es gibt über 500 Arten von Kegelschnecken (Familie Conidae), die Jagd auf Fische machen und dabei spezielle Nervengifte einsetzen, um die Beute innerhalb weniger Sekunden zu betäuben und kampfunfähig zu machen. Einige dieser Gifte sind auch für den Menschen gefährlich, teils sogar tödlich.
Chemisch gesehen sind diese Conotoxine recht kleine Peptide, die Zahl der Aminosäuren liegt zwischen 13 und 29 [1,5]. Die kurzen Peptide enthalten übermäßig viel Cystein und werden durch viele Disulfidbrücken stabilisiert [1,5]. Weil die Conotoxin-Moleküle so klein sind, gelangen sie sehr schnell an ihre Zielorte.
Kegelschnecken produzieren meistens nicht nur ein Conotoxin, sondern injizieren gleich einen ganzen "Cocktail" verschiedener Conoxine in das Beutetier, die sich gegenseitig verstärken (synergistischer Effekt) [2]. Manche Kegelschnecken produzieren bis zu 200 verschiedene Giftstoffe gleichzeitig [6].
Die Conotoxine werden unterteilt in $\alpha-, \omega-, \mu-$ und $\delta-$Conotoxine (alpha, omega, my und delta).
Die einzelnen Conotoxine
Die Conotoxine greifen Acetylcholin-Rezeptoren und Ionenkanäle an, vor allem Natriumkanäle und Calciumkanäle.
$\alpha$-Conotoxin
Das $\alpha$-Conotoxin besetzt die Rezeptoren für Acetylcholin in der postsynaptischen Membran von Muskelzellen. Die ligandengesteuerten Natriumkanäle in der Membran der Muskelzellen sind blockiert, sie können sich nicht mehr öffnen. Die Muskeln können nicht mehr kontrahieren; der Fisch ist gelähmt.
$\omega$-Conotoxin
Das $\omega$-Conotoxin blockiert die Freisetzung von Acetylcholin an der motorischen Endplatte, indem es die spannungsgesteuerten Calciumkanäle blockiert. Calcium-Ionen können nicht mehr in das synaptische Endknöpfchen einströmen, daher können die synaptischen Vesikel nicht mehr zur präsynaptischen Membran transportiert werden und mit dieser verschmelzen. Eine synaptische Übertragung ist nicht mehr möglich, der Muskel kann nicht erregt werden, der Fisch ist gelähmt. Inzwischen wird dieses $\omega$-Conotoxin bei der menschlichen Schmerztherapie eingesetzt. Wenn eine bestimmte Dosis direkt in das Rückenmark injiziert wird, kann die Übertragung der Schmerzinformation zum Gehirn blockiert werden.
$\mu$-Conotoxin
Das $\mu$-Conotoxin blockiert spannungsgesteuerte Natriumkanäle der Muskelmembran, so dass dort keine Aktionspotenziale entstehen. Der Muskel kann nicht mehr kontrahieren, der Fisch ist völlig gelähmt.
$\delta$-Conotoxin
Das $\delta$-Conotoxin wirkt auf die spannungsgesteuerten Natriumkanäle der motorischen Axone und bewirkt, dass sich diese Na+-Kanäle nach einem Aktionspotenzial nur sehr langsam wieder schließen.
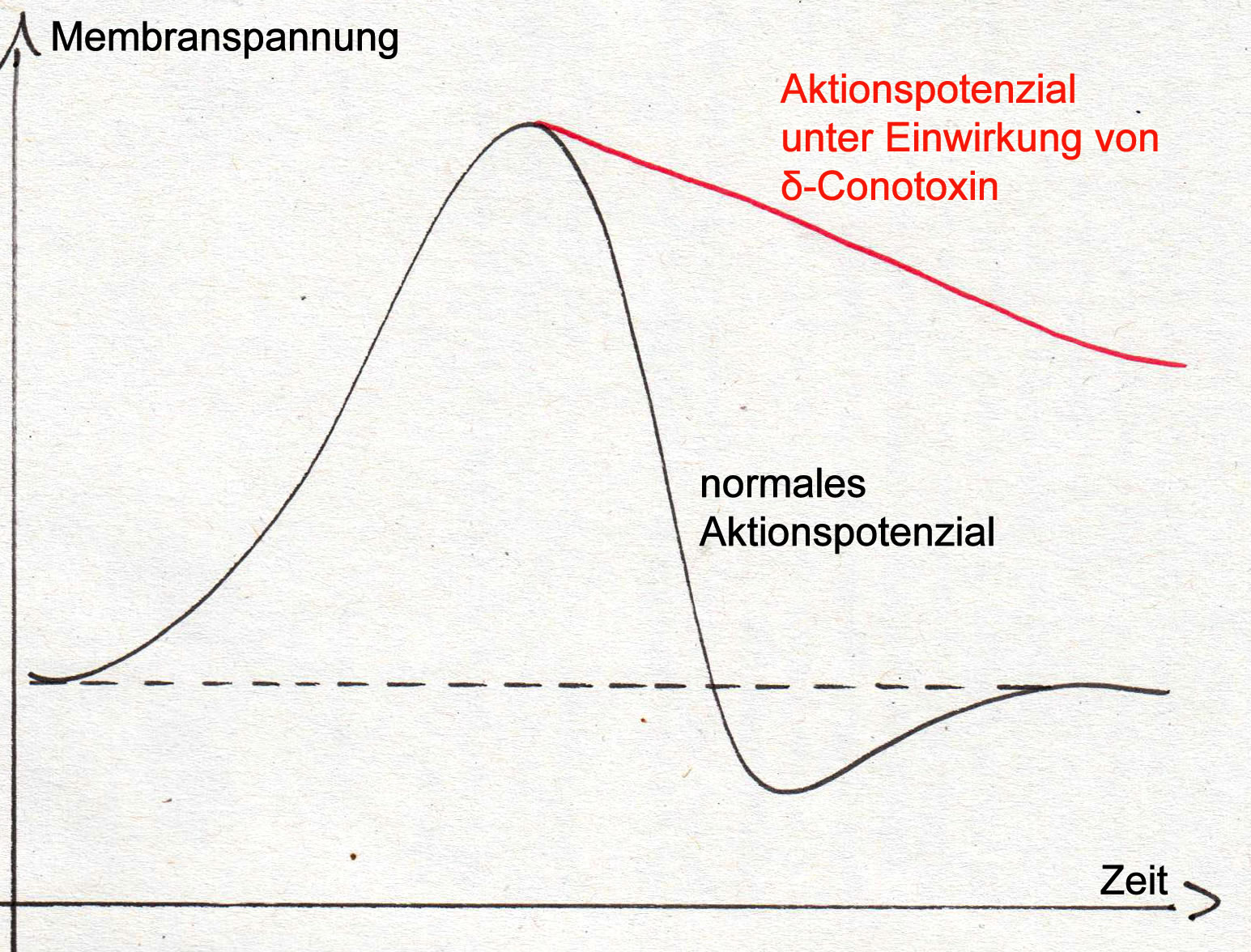
Wirkung von delta-Conotoxin auf ein Aktionspotenzial an einem Motoneuron
$\delta$-Conotoxin bewirkt also deutlich verlängerte Aktionspotenziale.
Die so ausgedehnten Aktionspotenziale wirken sich dann auf die spannungsgesteuerten Calciumkanäle des synaptischen Endknöpfchens aus, es strömen über eine längere Zeit Calcium-Ionen ein, mehr synaptische Vesikel verschmelzen mit der präsynaptischen Membran, und eine stark erhöhte Freisetzung des Neurotransmitters Acetylcholin ist die Folge. Die postsynaptische Membran der Muskelzelle wird übererregt, und der Muskel verkrampft [3].
$\kappa$-Conotoxin
Das $\kappa$-Conotoxin wirkt auf die spannungsgesteuerten Kaliumkanäle der motorischen Axone und bewirkt ähnlich wie das $\delta$-Conotoxin eine Verzögerung / Verlängerung der Aktionspotenziale. Eine Kontraktion des verbundenen Muskels ist die Folge. Beim Herzmuskel kann das zu Herzversagen führen [2].
$\delta$- und $\kappa$-Conotoxine wirken synergistisch, das heißt, sie ergänzen sich gegenseitig in ihrer verzögernden Wirkung auf die Repolarisationsphasen der Aktionspotenziale motorischer Nerven, was dann zu einer maximalen Muskelkontraktion führt [2].
Conotoxine als Schmerzmittel
Mediziner unterscheiden bei chronischen Schmerzen die beiden Typen entzündlich und neuropathisch.
Der erste Typ wird - wie der Name schon sagt - durch Entzündungen hervorgerufen. Behandelt man die Entzündung erfolgreich, sollte der Schmerz wieder verschwinden. Neuropathische Schmerzen dagegen sind oft auf Schäden der Nervenfasern selbst, verursacht durch Verletzungen oder bestimmte Krankheiten [4].
Das $\omega$-Conotoxin findet inzwischen in der Schmerztherapie Anwendung. Es muss dazu direkt in die Rückenmarksflüssigkeit injiziert werden. Eine Verabreichung in Tablettenform ist nicht möglich, weil das Conotoxin im Verdauungstrakt abgebaut würde.
Conotoxine im Abitur NRW
In der Abituraufgabe "Jagdgifte der Meeresschnecken" von 2007 wird die Wirkung von vier Conotoxinen in den Mittelpunkt gestellt. Auch auf den Einsatz von $\omega$-Conotoxin in der Schmerztherapie wird eingegangen.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992, Artikel "Conotoxine".
- Fact Sheet "Conotoxine" auf labor-spiez.ch
- "Vom Jagdgift zur neuen Schmerztherapie". Ein Artikel von Ilva Putzier und Stephan Frings in Biologie in unserer Zeit 3/2002, S. 148ff.
- "Neue Hoffnung bei chronischem Schmerz". Ein Artikel von Stephani Sutherland in Spektrum der Wissenschaft 10/2015.
- "Conotoxine". Spektrum-Lexikon der Neurowissenschaft.
- "Die Gifte der Kegelschnecken". Ein Artikel in Forschung Frankfurt 2/2005.
- "Die Gifte der Kegelschnecken - Lernen aus 50 Millionen Jahren Neuropharmakologie". Ein Artikel der Max-Planck-Gesellschaft von 2003.