Definition
In der MO-Theorie liegt ein Triplett-Zustand immer dann vor, wenn zwei ungepaarte Elektronen mit gleichem Spin zwei "benachbarte" Molekülorbitale besetzen. Das soll am Beispiel des Sauerstoff-Moleküls illustriert werden.
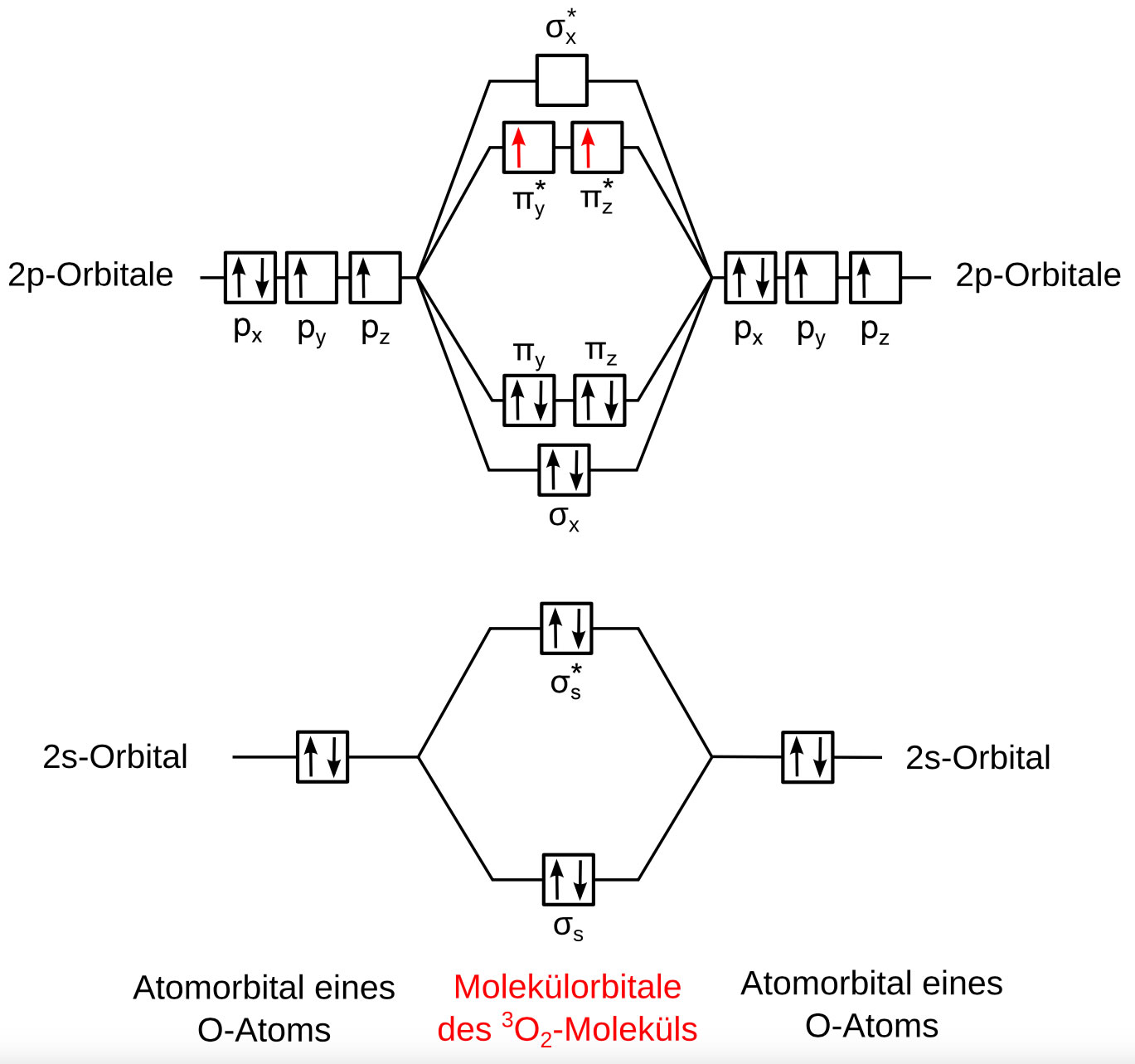
Die Molekülorbitale des O2-Moleküls
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license. Author: Muskid
Dieses Bild aus der deutschen Wikipedia zeigt die Molekülorbitale des Sauerstoff-Moleküls. Links und rechts sind die Atomorbitale von zwei O-Atomen zu sehen, in der Mitte die bindenden und antibindenden Molekülorbitale des O2-Moleküls.
Im Sauerstoff-Molekül sind die beiden O-Atome durch eine sigma-Bindung eine eine pi-Bindung miteinander verbunden. Die beiden 2s-Orbitale der beiden O-Atome bilden ein bindendes und ein antibindendes Molekülorbital. Jedes dieser beiden MOs ist mit zwei Elektronen besetzt. Das Resultat: Die s-Orbitale tragen nicht zur O=O-Bindung bei, da sich die MOs praktisch gegenseitig aufheben.
Von den p-Orbitalen der beiden O-Atome ist eines doppelt besetzt (px), während die beiden anderen (py, pz) nur einfach besetzt sind. Diese einfach besetzten p-Orbitale kombinieren dann zu insgesamt vier Molekülorbitalen.