Allgemeines
Amine sind eine Stoffgruppe der organischen Chemie, die rein formal vom Ammoniak NH3 ableitet - ähnlich wie sich Alkohole und Ether formal vom Wasser H2O ableiten.
Hier ein paar Beispiele:
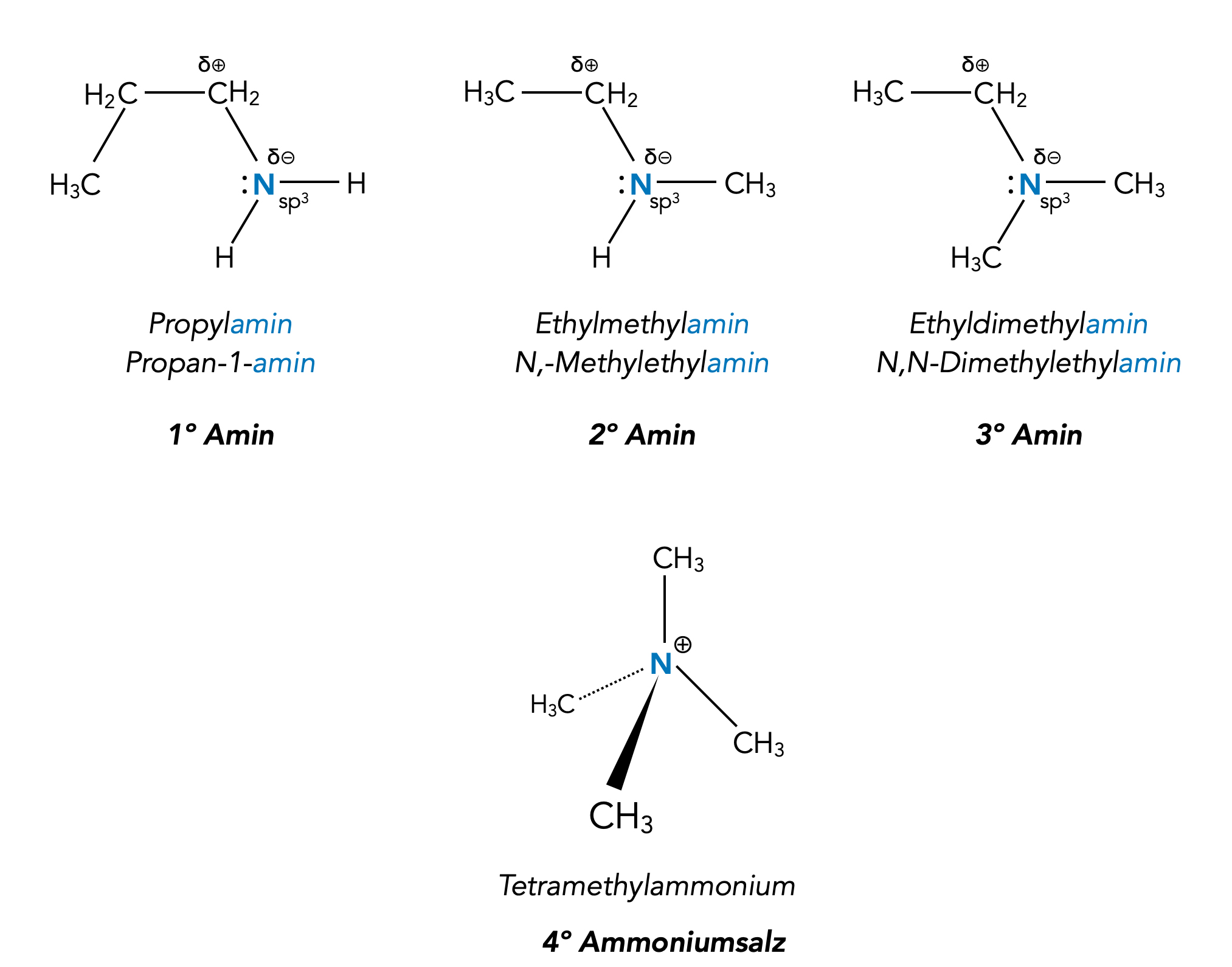
Primäre, sekundäre, tertiäre Amine und ein quartäres Ammonium-Kation
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei primären Aminen ist nur ein Wasserstoff-Atom des Ammoniaks durch eine Alkyl-Gruppe ersetzt, bei sekundären zwei und bei tertiären Aminen wurden alle drei H-Atome ersetzt.
Quartäre Amine, also Verbindungen, bei denen ein N-Atom mit vier Alkylgruppen verbunden ist, sind streng genommen keine Amine mehr, sondern quartäre Ammoniumsalze. Das Gegen-Anion, zum Beispiel Cl-, ist in der Abbildung nicht berücksichtigt worden.
Aromatische Amine
Das folgende Bild zeigt die Verbindungen Anilin und Pyridin.
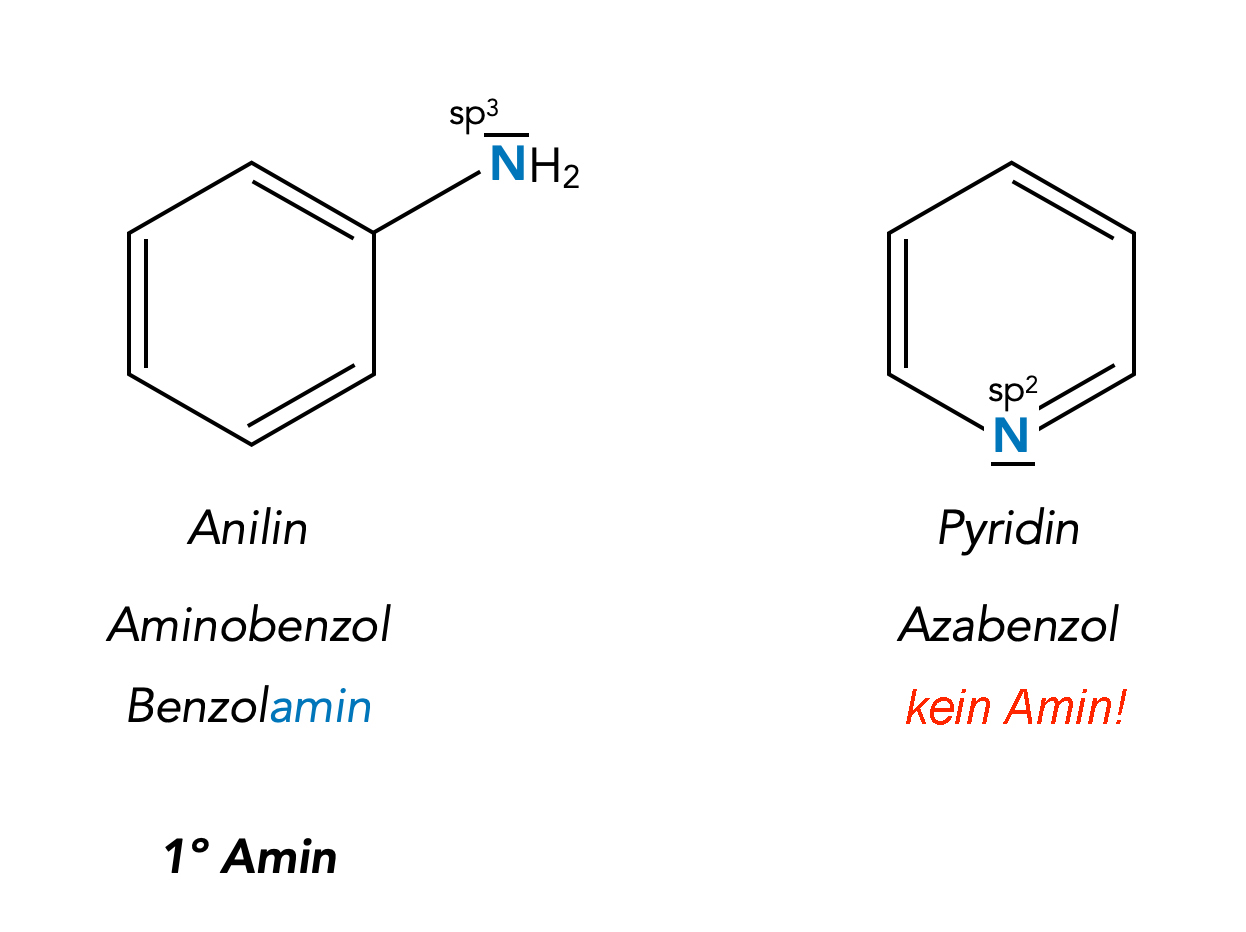
Anilin und Pyridin
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Anilin, ein sehr wichtiger Grundstoff der chemischen Industrie, ist ein primäres Amin, erkennbar an den beiden H-Atomen am sp3-hybridisierten N-Atom.
Rechts sehen wir das Pyridin. Das Molekül des Pyridins ist ein Benzolring, bei dem ein C-Atom durch ein sp2-hybridisiertes N-Atom ersetzt wurde. Das freie Elektronenpaar des N-Atoms ist nicht Bestandteil des aromatischen pi-Systems, sondern ist von außen frei zugänglich und verleiht der Verbindung die Eigenschaften einer Lewis-Base, ähnlich wie bei den primären, sekundären und tertiären Aminen. Allerdings gehört Pyridin nicht zu dem tertiärenAminen, sondern zur Stoffgruppe der aromatischen Heterocyclen.
Aminosäuren
Die Aminosäuren könnte man theoretisch auch zu den Aminen zählen, wenn da nicht die COOH-Gruppe wäre, die eine höhere Priorität hat als die NH2-Gruppe. Somit gehören die Aminosäuren eher zu den Carbonsäuren.
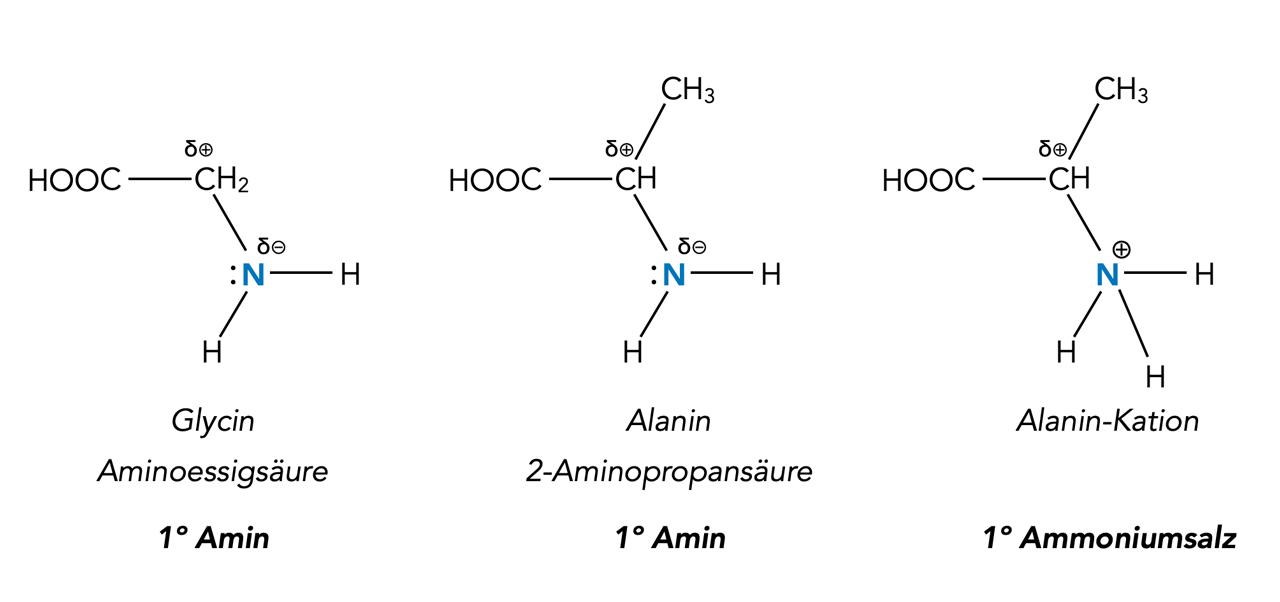
Die Aminosäuren Glycin und Alanin sowie das Alanin-Kation
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Physikalische Eigenschaften
Aliphatische Amine wie Methylamin CH3-NH2 oder Dimethylamin (CH3)2-NH sind bei Raumtemperatur gasförmig. Mit zunehmender Größe und Anzahl der Alkylgruppen steigt aber der Siedepunkt an und die Amine werden bei Zimmertemperatur flüssig oder sogar fest.
Anilin, das einfachste aromatische Amin, ist bei 20 ºC flüssig, viele Anilin-Derivate dagegen sind fest.
Da Amine wegen des freien Elektronenpaars am N-Atom H-Brücken mit Wasser-Molekülen ausbilden können, ist die Wasserlöslichkeit kleinerer Amine recht gut. Ähnlich wie bei Alkoholen nimmt die Wasserlöslichkeit aber mit steigender Kettenlänge der Alkylgruppen ab. Aromatische Amine wie Anilin sind überhaupt nicht wasserlöslich.
Amine haben einen typischen, fischartigen Geruch - jedenfalls die gasförmigen Amine. Manche Amine haben auch einen Geruch nach Fäkalien, Urin oder verwesendem Fleisch. Das liegt daran, dass beim Abbau organischer Materie, also von toten Tieren oder Pflanzen, viele gasförmige Amine freigesetzt werden.
Typische Reaktionen
Amine als Brönsted-Basen
Ähnlich wie Ammoniak können auch Amine ein Proton aufnehmen, sie sind also Protonen-Akzeptoren bzw. Brönsted-Basen.
Schauen wir uns die pKB-Werte von vier Aminen an:
- Ammoniak NH3 : 4,75
- Methylamin CH3-NH2 : 3,36
- Dimethylamin (CH3)2-NH : 3,26
- Trimethylamin (CH3)3-N : 4,19
Zur Erinnerung: Je kleiner der pKB-Wert, desto stärker die Base. Dimethylamin ist hier also die stärkste Base, nimmt also am leichtesten ein Proton auf.
Der +I-Effekt der Alkyl-Gruppen erhöht die Basizität, daher sollte eigentlich Trimethylamin mit seinen drei Alkyl-Gruppen die stärkste Base sein. Das ist jedoch nicht der Fall, der pKB-Wert ist sogar größer als der des Methylamins. Der Grund hierfür könnten sterische Effekte sein. Die drei Methylgruppen verdecken das freie Elektronenpaar des N-Atoms stärker als zwei Methylgruppen, daher haben Protonen es schwieriger, sich an das N-Atom zu setzen.
Amine als Lewis-Basen bzw. Nucleophile
Wegen ihres freien Elektronenpaars können sich Amine auch als Lewis-Basen bzw. Nucleophile betätigen.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 1 (1989), S. 41.
- Wikipedia, Artikel "Amine"