SN1 und SN2 als Grenzfälle
Wir haben die SN1-Reaktion und die SN2-Reaktion kennengelernt und gründlich untersucht. Auch die Frage, unter welchen Bedingungen eher eine SN1- bzw. eine SN2-Reaktion stattfindet, haben wir ausführlich besprochen.
Allerdings ist es nicht so einfach, wie es auf den ersten Blick aussieht. Es gibt nicht nur SN1- und SN2-Reaktionen, sondern Reaktionstypen, die irgendwo dazwischen liegen. SN1-Reaktion und SN2-Reaktion sind nur zwei Grenzfälle, die sich besonders gut beschreiben lassen und damit auch für den gymnasialen Oberstufenunterricht geeignet sind.
Um diese vielen Möglichkeiten zu beschreiben, die zwischen den beiden Grenzfällen liegen, hat Saul Winstein das Konzept der Ionenpaare entworfen.
Ionenpaare
Betrachten wir dazu einmal die Dissoziation eines Substrats R-X. Nach dem idealen SN1-Mechanismus trennt sich das Nucleofug X vollständig von dem Substrat, und zurück bleibt ein Carbenium-Ion. Wie sieht die Sache nun nach Winstein tatsächlich aus?
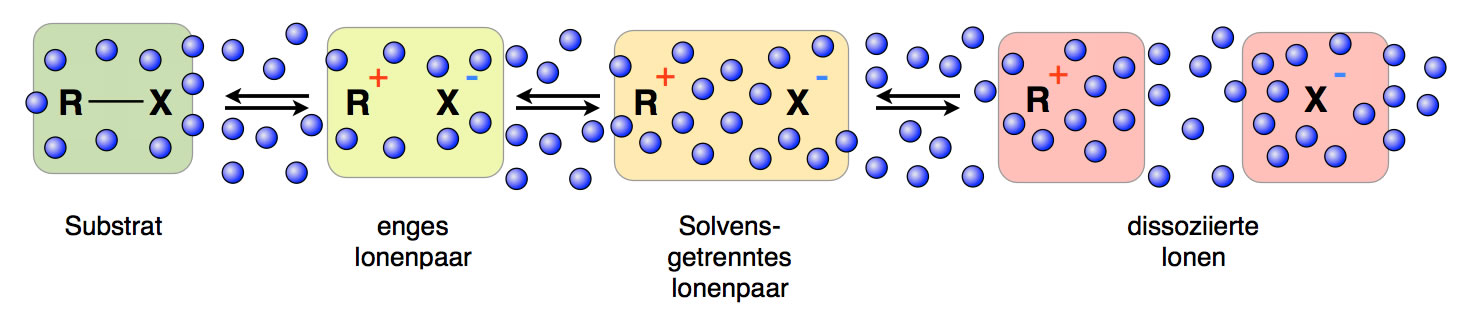
Das allmähliche Auseinander-Dissoziieren des Ionenpaars
Betrachten wir das Substrat R-X ganz links. Sobald sich die kovalente R-X-Bindung heterolytisch auflöst, liegt ein enges Ionenpaar vor; die beiden Ionen berühren sich sozusagen noch, es haben sich noch keine Moleküle des Lösemittels zwischen die Ionen geschoben.
Im weiteren Verlauf der Dissoziation bildet sich ein solvensgetrenntes Ionenpaar. Da heißt, zwischen den beiden Ionen befinden sich schon ein paar Lösemittel-Moleküle (Solvens = Lösemittel).
Im letzten Schritt befinden sich nicht nur ein paar Solvens-Moleküle zwischen den Ionen, sondern die Ionen sind vollständig getrennt und ziehen sich auch nicht mehr gegenseitig an.
Das Interessant an diesem Konzept ist Folgendes: In jedem dieser vier Stadien (Substrat, enges Ionenpaar, solvensgetrenntes Ionenpaar, dissoziierte Ionen) kann das Ionenpaar von einem Nucleophil angegriffen werden, was dann zu unterschiedlichen Resultaten führt.
Angriff auf das enge Ionenpaar
Wenn sich noch keine Solvens-Moleküle zwischen dem Carbenium-Ion und dem Nucleofug befinden, kommt es zu einer SN2-Reaktion mit vollständiger Inversion der Molekülstruktur. Das Carbenium-Ion kann nur von der Rückseite angegriffen werden, da das eng verbundene Nucleofug-Anion das Carbenium-Ion von seiner Seite abschirmt.
Angriff auf das solvensgetrennte Ionenpaar
Hier sieht die Sache schon anders aus. Das Carbenium-Ion kann von allen Seiten vom Nucleophil angegriffen werden. Allerdings befindet sich das ausgetretene Nucleofug noch in der Nähe des Carbenium-Ions und schirmt es daher von dieser Seite etwas ab. Greift das Nucleophil von der Rückseite her an (höhere Wahrscheinlichkeit), so erfolgt eine Inversion des Substrats. Greift das Nucleophil dagegen von der Vorderseite her an (geringere Wahrscheinlichkeit), so bleibt die Raumstruktur des Substrats erhalten, man spricht dann von einer Retention (Konfigurations-Erhaltung). Insgesamt kann man in diesem Fall eine partielle Inversion beobachten.
Angriff auf die dissoziierten Ionen
Wenn das Nucleophil erst dann angreift, wenn die Ionen vollständig getrennt sind, haben wir es mit einer klassischen SN1-Reaktion zu tun. Das Nucleophil kann mit gleicher Wahrscheinlichkeit von der Vorderseite und von der Rückseite her angreifen. Die Bildung eines Racemat ist dann das Ergebnis dieser Reaktion.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995